|
|
Costantino Salerno |
|
|
Appunti di Biochimica Clinica |
|
|
11. ESAME DELLE URINE
I reni sono l’organo principale dell’apparato emuntorio e presentano, dal punto di vista strutturale, la costituzione istologica di una grossa ghiandola tubulare composta. Ciascun rene comprende circa un milione di unità funzionali chiamate nefroni. Ogni nefrone è formato da un glomerulo, responsabile dell’ultrafiltrazione del sangue, e da una successione di strutture tubulari (tubulo contorto prossimale, ansa di Henle, tubulo contorto distale) sfocianti nei dotti collettori (tubuli retti, canali papillari), che rappresentano la parte escretrice della ghiandola (Fig. 11.1). Oltre alle cellule che rivestono il nefrone ed i vasi, nella midollare del rene sono presenti delle cellule interstiziali responsabili della secrezione delle prostaglandine.
Fig. 11.1. (A) Rappresentazione schematica del nefrone. 1: glomerulo, 2: tubulo contorto prossimale; 3: ansa di Henle; 4: tubulo contorto distale; 5: dotti collettori. (B) Glomerulo renale. 1: capsula di Bowman; 2: arteriola afferente; 3: arterola efferente; 4: tubulo contorto prossimale; 5: parte ascendente dell’ansa di Henle; 6: apparato iuxtaglomerulare. (C) Capillari glomerulari. 1: lume del capillare; 2: cellula endoteliale; 3: podocita; 4: membrana basale e diaframma a fessura.
I glomeruli sono formati da un insieme di capillari raggomitolati a matassa e raccolti nella dilatazione terminale a fondo cieco dei nefroni (capsula di Bowman), situata nella parte più superficiale del rene (corticale). Il filtrato glomerulare è formato dal liquido che fuoriesce dai capillari attraversando le fenestrature delle cellule endoteliali, la membrana basale e il diaframma a fessura costituito dai processi podocitari delle cellule epiteliali della capsula. Le dimensioni relativamente piccole delle fenestrature impediscono in gran parte il passaggio della frazione corpuscolata del sangue. Nei glomeruli sono presenti inoltre delle cellule mesangiali di forma stellata che svolgono una funzione di regolazione della filtrazione glomerulare e di fagocitosi nei confronti di particelle di grandi dimensioni provenienti dal plasma, come ad esempio gli immunocomplessi, svolgendo in tal caso un ruolo importante nella patogenesi di alcune nefropatie glomerulari.
Il tubulo contorto prossimale ha una lunghezza di circa 15 mm ed è composto da un singolo strato di cellule provviste, sul versante luminale, di microvilli disposti a guisa di orletto a spazzola che forniscono al tubulo prossimale l’ampia superficie necessaria alla sua funzione di riassorbimento attivo della maggior parte dei soluti filtrati, accompagnati da un volume isosmotico di acqua. Sono così riassorbiti pressoché completamente in questo segmento il glucosio, gli aminoacidi, il bicarbonato e il potassio, insieme a circa 2/3 del sodio filtrato. Alcune sostanze sono secrete dal tubulo prossimale come, ad esempio, la creatinina, alcuni steroidi e i loro glicuronidi, le pennicilline e dei derivati dell’acido ippurico come l’acido p-aminobenzoico.
Le anse di Henle, il cui glomerulo è situato nella corticale, sono in gran parte di lunghezza relativamente limitata, mentre quelle poste più in profondità (appartenenti a circa il 15% dei nefroni) sono più lunghe, fino a 14 mm, e si estendono nella midollare del rene. Il segmento sottile del ramo discendente dell’ansa si piega su se stesso risalendo, con il tratto ascendente, fino in prossimità del glomerulo del nefrone di cui fa parte. Le cellule epiteliali di questa zona del nefrone (macula densa) svolgono una funzione di regolazione della increzione della renina che è prodotta dalle cellule mioepitelioidi iuxtaglomerulari della parete dell’arteriola afferente al glomerulo stesso (vedi Par. 10.5.1b). Le cellule mioepitelioidi iuxtaglomerulari, assieme a quelle della macula densa e ad alcune cellule contigue, formano l’apparato iuxtaglomerulare. L’ansa di Henle è essenziale per l’eliminazione dell’acqua e per la formazione di urina concentrata. Il processo consiste nel trasporto attivo di soluti (principalmente ioni sodio e cloro), ma non dell’acqua, fuori dal tratto spesso della branca ascendente, rendendo ipertonico il liquido interstiziale circostante. Poiché l’acqua può diffondere dal tratto sottile della branca discendente, l’effetto netto è che il liquido nell’ansa e nell’interstizio adiacente diventa sempre più ipertonico procedendo progressivamente dal limite cortico-midollare alle zone più profonde della midollare, mentre il liquido che dalla branca ascendente entra nel tubulo contorto distale diventa ipotonico rispetto al plasma. La diffusione dell’urea dal tratto sottile ascendente dell’ansa e dai dotti collettori (vedi oltre) all’interstizio contribuisce in misura rilevante all’ipertonicità della midollare. Infatti, nell’adulto, la capacità di concentrare del rene dipende dall’apporto proteico, mentre, nel neonato, la ridotta funzionalità renale è dovuta alla ridotta quantità di urea disponibile.
Il tubulo contorto distale ha una lunghezza di circa 5 mm ed è costituito da cellule prive dell’orletto a spazzola, destinate all’assorbimento, e da cellule intercalate, destinate alla secrezione degli idrogenioni. Per stimolazione da parte dell’aldosterone, in questa porzione del nefrone avviene il riassorbimento del sodio, che è a sua volta scambiato con gli idrogenioni ed il potassio.
I dotti collettori si estendono dall’estremità terminale dei tubuli contorti distali alle papille renali. Nella parte corticale dei dotti continua il riassorbimento del sodio in cambio del potassio e degli idrogenioni, mentre il segmento midollare è parzialmente permeabile all’urea che, fuoriuscendo nell’interstizio, contribuisce a mantenere alta l’osmolatità della midollare. Sotto stimolazione della vasopressina, le cellule dei dotti diventano permeabili all’acqua che viene richiamata nell’interstizio ipertonico, generando urina concentrata (vedi Par. 10.1).
Le arteriole efferenti dai glomeruli corticali si suddividono in un plesso capillare che si dispone attorno ai tubuli, mentre quelle che derivano dai glomeruli iuxtamidollari formano i vasa recta che si spingono nella midollare a varia profondità, formando dei plessi capillari attorno alle anse di Henle, per poi risalire verso la corticale e terminare nelle vene renali. I vasa recta costituiscono un sistema di scambio in controcorrente essenziale per regolare la concentrazione dei soluti nell’urina. Il processo di filtrazione glomerulare dipende da una adeguata pressione di perfusione. Il flusso ematico renale (circa 1,2 L/min corrispondenti al 20-25% della gittata cardiaca) è indipendente dalla pressione arteriosa sistemica media entro i limiti di 80-200 mmHg. Una diminuzione della perfusione renale stimola la liberazione di renina dalle cellule dell’apparato iuxtaglomerulare. Questo enzima converte l’angiotensinogeno circolante in angiotensina I che, a sua volta, viene trasformata dall’enzima di conversione in angiotensina II, un potente vasocostrittore nonché uno stimolatore dell’increzione di aldosterone. Se il flusso di sangue nel rene è insufficiente, si liberano delle prostaglandine che, causando vasodilatazione, contribuiscono in parte al mantenimento della perfusione renale
11.1. ESAME DEI CARATTERI FISICO-CHIMICI
Il volume delle urine delle 24 ore subisce ampie variazioni in relazione alla quantità di acqua ingerita ed alle perdite extrarenali di liquido (principalmente attraverso la sudorazione) ed è, nell’adulto, compreso tra 600 e 2000 mL. Una condizione di poliuria si può avere come conseguenza di una eccessiva introduzione di liquidi, nel diabete (insipido e mellito) e in una certa fase dell’insufficienza renale cronica quando il rene ha perso la capacità di concentrare l’urina. Una condizione di oliguria si osserva in casi di ridotto apporto o di eccessiva perdita di liquidi, di diminuito afflusso di sangue ai reni o di affezioni renali. La mancata eliminazione di urine (anuria) è dovuta a gravi lesioni renali o ad ostruzione delle vie urinarie.
L’intensità del colore delle urine dipende fra l’altro
dal suo grado di concentrazione e può andare, in condizioni
normali, dal giallo molto pallido al giallo ambra più o meno
carico per la presenza di pigmenti (urocromo, uroeritrina, etc.)
generalmente privi di significato clinico. Le urine possono
assumere un colore inusuale in seguito all’ingestione di
alcuni medicamenti: verde blu con il blu di metilene, brune con
il chinino, giallo carico con alcune vitamine del complesso B,
rosa con il piramidone ed altri antireumatici. Fra le sostanze
patologiche, la bilirubina conferisce all’urina una
colorazione che va dal giallo oro, al giallo verdastro, al bruno
(color marsala) a seconda della quantità; l’urobilina, se
molto abbondante, dà un colore giallo arancio con fluorescenza
verdastra; l’emoglobina dà un colore che va dal rosa al
rosso; l’acido omogentisico, presente in soggetti affetti
da alcaptonuria ![]() , fa virare il colore delle urine verso il
bruno-nerastro quando sono esposte all’aria.
, fa virare il colore delle urine verso il
bruno-nerastro quando sono esposte all’aria.
Normalmente le urine appena emesse sono limpide. Lasciate a sé
per qualche tempo possono intorbidarsi per la precipitazione di
sali poco solubili, come i fosfati di calcio nelle urine alcaline
e gli urati. Questi ultimi precipitano a pH acido e/o a bassa
temperatura e possono formare un deposito granuloso rossastro per
la presenza di uroeritrina (sedimento laterizio). I soggetti con
malattie riguardanti i reni o le vie urinarie possono presentare
urine torbide per la presenza di muco, leucociti (pus), emazie,
batteri e miceti. Nelle urine possono essere inoltre presenti
cellule epiteliali dell’apparato escretore e cilindri
costituiti da materiale proteico (principalmente uromucoide, vedi
Par. 11.2) precipitato nei lumi tubulari a pH
acido e conglobante, a volte, vari elementi corpuscolati
![]() .
.
Il pH urinario può variare fra 4,5 e 8,0. Esso dipende da una complessa serie di reazioni che si verificano a livello del tubulo renale (riassorbimento di bicarbonati, scambio tra ioni H+ e ioni Na+, formazione di NH4+) ed è influenzato dalla dieta: è più basso con una dieta ricca di proteine, mentre è più alto con una dieta vegetariana. Normalmente, un’ora dopo il pasto il pH urinario tende ad innalzarsi in conseguenza della maggiore secrezione di acido cloridrico con il succo gastrico. Urine nettamente acide si possono avere in corso di acidosi diabetica e nelle varie forme di acidosi metabolica e respiratoria, mentre urine alcaline vengono osservate nell’alcalosi metabolica e respiratoria.
Il peso specifico relativo dell’urina è dato dalle sostanze che vi sono disciolte (prevalentemente urea, cloruri, fosfati e solfati) ed è compreso tra 1,016 e 1,022. Aumenti marcati (fino a 1,040) si hanno nel diabete mellito a causa della presenza di glucosio o nell’oliguria, mentre una diminuzione del peso specifico (ipostenuria) può osservarsi nei casi di eccessiva introduzione di liquidi, nel diabete insipido (per mancato riassorbimento tubulare dell’acqua) o nella nefrite cronica. Quando le urine presentano un peso specifico relativo di 1,010 (corrispondente a quello del plasma privo di proteine) si parla di isostenuria.
11.1.1. Metodi di determinazione
La determinazione dei vari costituenti delle urine viene eseguita generalmente con le stesse metodiche impiegate per il sangue e descritte nei capitoli precedenti. La ricerca qualitativa dei più comuni componenti patologici è facilitata dall’uso di particolari strisce reattive o di compresse contenti tutti i rettivi necessari alla evidenziazione degli analiti mediante l’ausilio di una scala cromatica. In Tab.11.I viene riportato un elenco di alcune componenti dell’urina.
| Tab.11.I. Componenti chimici delle urine | ||||
| eliminazione giornaliera |
metodi |
|||
| Sodio | 50-200 mEq | Par. 12.1.1 | ||
| Potassio | 30-90 mEq | Par. 12.2.1 | ||
| Cloruri | 100-250 mEq | Par. 12.3.1 | ||
| Calcio | 3 - 7 mmol | Par. 12.4.1 | ||
| Magnesio | 1 -10 mmol | Par. 12.5.1 | ||
| Fosfato | 16-29 mmol | Par. 12.6.1 | ||
| Ossalato | < 0,53 mmol | Par. 11.1.1a | ||
| Citrato | 50-250 mg |
Par. 11.1.1b | ||
| Acido urico | 250-750 mg | Par. 4.1.3 | ||
| Creatinina | 12-26 mg/kg | Par. 6.4.1 | ||
| Indacano | < 20 mg | Par. 11.1.1c | ||
| Sali biliari | 0 | Par. 11.1.1d | ||
| Nitriti | 0 | Par. 11.1.1e | ||
11.1.1a. Ossalato
![]()
Fig. 11.2. Acido ossalico
L’acido ossalico (vedi Par. 11.3) può essere determinato nelle urine con metodi che comportano una precipitazione diretta dell’analita, una sua estrazione con solventi o un’analisi enzimatica.
L’analita viene precipitato come ossalato di calcio, praticamente insolubile a pH neutro o alcalino. Il precipitato è lavato con soluzione ammoniacale, ridisciolto in acido solforico (0,5 N) e quindi titololato con permanganato di potassio. La determinazione è resa difficoltosa nelle urine per la presenza di sostanze che influenzano negativamente la precipitazione (fosfato, magnesio) o reagiscono con il permanganato (urato, citrato).
I metodi che impiegano la tecnica di estrazione (generalmente in etere) eliminano in parte i problemi delle interferenze, ma le condizioni per una estrazione quantitativa sono estremamente critiche. L’acido ossalico marcato con 14C può essere usato per il controllo della resa dei metodi che prevedono la precipitazione o l’estrazione dell’analita.
La determinazione enzimatica dell’acido ossalico richiede l’uso dell’ossalato decarbossilasi.
![]()
La reazione può essere seguita misurando la variazione di pH dovuta alla liberazione di CO2 in un tampone alcalino o determinando direttamente il CO2 prodotto mediante una tecnica gasmanometrica o enzimatica (utilizzante la formiato deidrogenasi).
![]()
11.1.1b. Citrato
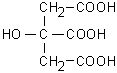
Fig. 11.3. Acido citrico
L’acido citrico
![]() può essere determinato colorimetricamente in presenza
di anidride acetica, acido tricloroacetico e piridina, misurando
l’assorbimento del prodotto di
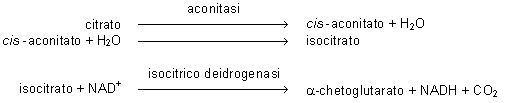
reazione a 440 nm. Una determinazione enzimatica prevede l’azione combinata dell’aconitasi
e della isocitrico deidrogenasi.
può essere determinato colorimetricamente in presenza
di anidride acetica, acido tricloroacetico e piridina, misurando
l’assorbimento del prodotto di
reazione a 440 nm. Una determinazione enzimatica prevede l’azione combinata dell’aconitasi
e della isocitrico deidrogenasi.
11.1.1c. Indacano
Fig. 11.4. Indacano
L’indacano
![]() viene ossidato a indaco blu dal
cloruro ferrico in acido cloridrico (reattivo di Obermayer). I
pigmenti biliari, che interferiscono con la reazione, sono
allontanati adsorbendoli con cloruro di bario, mentre il colore
rosso violetto sviluppato da altre sostanze (iodio, timolo) è
eliminato con l’aggiunta di un
riducente (tiosolfato).
viene ossidato a indaco blu dal
cloruro ferrico in acido cloridrico (reattivo di Obermayer). I
pigmenti biliari, che interferiscono con la reazione, sono
allontanati adsorbendoli con cloruro di bario, mentre il colore
rosso violetto sviluppato da altre sostanze (iodio, timolo) è
eliminato con l’aggiunta di un
riducente (tiosolfato).
11.1.1d. Sali biliari
Fig. 11.5. Sali biliari
Un saggio qualitativo per svelare la presenza
di sali biliari ![]() sfrutta
la loro proprietà di abbassare la tensione superficiale. Per
questo motivo i fiori di zolfo, che normalmente galleggiano sull’urina, precipitano in fondo in presenza di sali biliari
(test di Hay).
sfrutta
la loro proprietà di abbassare la tensione superficiale. Per
questo motivo i fiori di zolfo, che normalmente galleggiano sull’urina, precipitano in fondo in presenza di sali biliari
(test di Hay).
Una misura semiquantitativa (reazione di Pettenkofer) si basa sullo sviluppo di un colore rosso a seguito della reazione dei sali biliari con il furfuralo, formatosi per azione dell’acido solforico sul saccarosio. Prima della reazione il campione di urina viene concentrato per ebollizione.
11.1.1e. Nitriti
I nitriti (NO2-)
![]() sono fatti reagire con l’acido tartarico dando origine ad acido nitroso; questo
reagisce con l’acido arsenilico
formando acido arsenilico diazotato che si unisce alla N-(1-naftil)-etilendiammina
dando luogo a un prodotto di colore rosa. Per il saggio sono
generalmente usate delle strisce reattive contenti tutti i
composti necessari.
sono fatti reagire con l’acido tartarico dando origine ad acido nitroso; questo
reagisce con l’acido arsenilico
formando acido arsenilico diazotato che si unisce alla N-(1-naftil)-etilendiammina
dando luogo a un prodotto di colore rosa. Per il saggio sono
generalmente usate delle strisce reattive contenti tutti i
composti necessari.
11.1.2. Preparazione del campione
Nella maggior parte dei casi, l’esame delle urine è eseguito su un campione emesso al mattino e raccolto in bottiglie di plastica monouso. Per la determinazione di analiti la cui eliminazione non è generalmente uguale e costante nel tempo, è preferibile raccogliere le urine prodotte nelle 24 ore e riferirsi alla quantità totale di sostanza eliminata in questo intervallo di tempo. Un altro metodo è quello di rapportare la concentrazione dell’analita da esaminare a quella della creatinina, la cui eliminazione si suppone costante nel tempo (vedi Par. 6.4). Se le urine sono raccolte in un recipiente più grande, è bene agitare il campione in modo da riportare in sospensione il sedimento prima di prelevarne una frazione.
Per una esatta determinazione del pH urinario è necessario che questo venga valutato nelle urine appena emesse potendo variare profondamente per il sopravvenire di una abbondante crescita batterica con scissione dell’urea, liberazione di ammoniaca e intensa alcalinizzazione. Nelle urine lasciate a temperatura ambiente può verificarsi una lisi delle emazie e dei leucociti ed una distruzione dei cilindri.
Per alcuni dosaggi chimici (ormoni, catecolamine, etc.) le urine sono raccolte in recipienti di vetro scuro a tappo smerigliato contenenti sostanze atte ad assicurare la conservazione dei composti da esaminare.
11.2. PROTEINE URINARIE
Le proteine sono normalmente filtrate dai reni in ragione della loro concentrazione plasmatica e dimensione molecolare e della velocità di filtrazione glomerulare. In generale, il trasporto attraverso la membrana glomerulare diminuisce progressivamente con l’aumentare della massa molecolare delle proteine. Molecole di grandi dimensioni come le IgM (900 kDa; Par. 8.6.1b) o l’α2-macroglobulina (720 kDa; Par. 8.3.3) passano solo in tracce attraverso il glomerulo. L’albumina (66 kDa; Par. 8.1.1) passa nel filtrato in quantità piccole ma significative a causa della sua elevata concentrazione plasmatica e della sua minore grandezza. Proteine con massa molecolare inferiore a 40 kDa sono filtrate più liberamente, ma in minore quantità perché presentano basse concentrazioni plasmatiche.
In condizioni normali, solo le proteine di bassa massa molecolare e quindi facilmente filtrate presentano un significativo metabolismo renale, mentre le proteine più grandi (maggiori o uguali all’albumina) presentano un turnover renale trascurabile o molto basso. Le proteine sono riassorbite a livello dei tubuli prossimali mediante un processo di endocitosi con un meccanismo saturabile ad alta capacità, ma bassa affinità, e sono quindi idrolizzate ad aminoacidi che ritornano in circolo. Si ritiene che il riassorbimento inizi con l’interazione elettrostatica tra i residui di lisina ed arginina della proteina ed i siti carichi negativamente della membrana endoluminale. Infatti, l’infusione endovenosa di lisina, arginina o ornitina causa una proteinuria tubulare transiente, probabilmente dovuta al blocco temporaneo dei ricettori delle membrane tubulari con arresto dell’endocitosi. Peptidi di piccole dimensioni (angiotensina, bradichinina) sono probabilmente idrolizzati dalle proteasi dell’orletto a spazzola con produzione di aminoacidi e oligopeptidi che sono riassorbiti per mezzo di un sistema di trasporto specifico. Alcuni ormoni proteici (insulina, paratormone) interagiscono con i recettori sulla membrana controluminale delle cellule tubulari, dove sono parzialmente idrolizzati in grandi frammenti peptidici che sono a loro volta filtrati dal glomerulo e riassorbiti nel tubulo.
La produzione di proteine da parte delle cellule epiteliali tubulari è praticamente limitata alle IgA secretorie, con piccole quantità di IgM e IgE, all’uromucoide (proteina di Tamm-Horsfall) e all’urochinasi. Le IgA (Par. 8.6.1c) sono prodotte dalle plasmacellule e trasportate alle cellule epiteliali dei tubuli dove viene loro aggiunta una "proteina di trasporto" prima della secrezione nel lume tubulare. L’uromucoide consiste in subunità di 80 kDa variamente aggregate ed è probabilmente secreto nella parte ascendente dell’ansa di Henle e nei tubuli distali; contribuisce ad evitare il riassorbimento dell’acqua nel ramo ascendente dell’ansa di Henle e svolge una funzione protettiva sequestrando materiale potenzialmente lesivo e tendendo a precipitare durante l’acidificazione dell’urina sotto forma di un gel che include l’albumina e i componenti cellulari eventualmente presenti nel lume tubulare. L’urochinasi converte il plasminogeno in plasmina, che a sua volta scinde la fibrina (vedi Par. 7.3.2a); il probabile significato fisiologico di questa proteina (presente nelle urine sotto forma di due isoenzimi con proprietà immunochimiche simili) è di rimuovere la fibrina dalle strutture microvascolari renali dissolvendo i cilindri urinari.
Si distinguono abitualmente cinque tipi di proteinuria: prerenale, glomerulare, tubulare, secretoria e di origine tessutale.
11.2a. Proteinuria prerenale
Questo tipo di proteinuria compare quando vi è un notevole incremento della concentrazione plasmatica di una proteina, generalmente di basso peso molecolare. Ne consegue un aumento della quantità filtrata a livello glomerulare, tale da superare la capacità di riassorbimento tubulare, per cui la proteina è escreta con le urine. L’α1-antitripsina e l’orosomucoide (proteine della fase acuta di peso molecolare relativamente basso; vedi Par. 8.3.1 e Par. 8.2.3) possono essere escrete con le urine mediante questo meccanismo in condizioni di flogosi. Altri esempi sono dati dalla proteina di Bence Jones, dalla emoglobina, dalla mioglobina e dal lisozima.
La proteinuria di Bence Jones è dovuta alla presenza di
catene leggere (Par. 8.6)
delle immunoglobuline nell’urina ed è di frequente
riscontro nel mieloma multiplo e in altre neoplasie maligne
riguardanti i linfociti B. Sebbene il rene sia la sede principale
del normale catabolismo delle catene leggere, queste proteine, se
filtrate in una quantità eccessiva, hanno effetti tossici sui
tubuli prossimali e distali e contribuiscono allo sviluppo di una
sindrome di Fanconi ![]() e di una
insufficienza renale. Le catene leggere possono combinarsi con l’uromucoide
formando cilindri tipici del mieloma o causare la formazione di
depositi amiloidi nella membrana basale dei glomeruli e dei
tubuli con conseguente danneggiamento del nefrone.
e di una
insufficienza renale. Le catene leggere possono combinarsi con l’uromucoide
formando cilindri tipici del mieloma o causare la formazione di
depositi amiloidi nella membrana basale dei glomeruli e dei
tubuli con conseguente danneggiamento del nefrone.
L’emoglobina viene liberata nel sangue circolante per
emolisi intravasale, ma non può superare il filtro renale finché
non raggiunge concentrazioni superiori a 1 g/L in quanto quantità
inferiori vengono complessate con l’aptoglobina (Par.
8.1.3). La
mioglobina, che deriva da un processo di rabdomiolisi
![]() ,
viene invece prontamente filtrata dal glomerulo. Entrambe le
proteine non sono di per sé tossiche, ma fattori importanti che
ne determinano la tossicità sono la deidratazione e l’acidosi
in quanto l’ematina ferrica prodotta dalla degradazione dell’emoglobina
e della mioglobina provoca lesioni delle cellule epiteliali del
tubulo renale.
,
viene invece prontamente filtrata dal glomerulo. Entrambe le
proteine non sono di per sé tossiche, ma fattori importanti che
ne determinano la tossicità sono la deidratazione e l’acidosi
in quanto l’ematina ferrica prodotta dalla degradazione dell’emoglobina
e della mioglobina provoca lesioni delle cellule epiteliali del
tubulo renale.
Il lisozima compare nelle urine in corso di leucemia mielomonocitaria in conseguenza del suo aumento nel siero. Un suo aumento nelle urine può essere anche espressione di una proteinuria di tipo tubulare (vedi Par. 11.2c).
11.2b. Protenuria glomerulare
Questo è il tipo più comune di proteinuria, dovuta ad un
aumento della permeabilità glomerulare alle proteine plasmatiche.
Un danno glomerulare deve essere sempre sospettato quando la
proteinuria supera i 2 g nelle 24 ore, ma può accompagnarsi
anche a perdite proteiche di lieve entità. La proteinuria
glomerulare è definita "selettiva" se viene escreta l’albumina
da sola o assieme a proteine di peso molecolare inferiore o molto
simile (α1-antitripsina,
orosomucoide, transferrina; vedi Par.
8) e "non selettiva" quando sono
escrete anche proteine a peso molecolare più elevato
![]() .
In caso di cospicua proteinuria glomerulare, si può avere un
superamento della capacità proteinosintetica del fegato con
ipoalbuminemia e comparsa di edemi (sindrome nefrosica
.
In caso di cospicua proteinuria glomerulare, si può avere un
superamento della capacità proteinosintetica del fegato con
ipoalbuminemia e comparsa di edemi (sindrome nefrosica
![]() ).
Si può avere inoltre ipotransferrinemia e, per superamento della
capacità proteinosintetica delle plasmacellule,
ipogammaglobulinemia. La concentrazione dell’antitrombina
III si riduce concomitantemente all’albumina con aumento del
rischio di complicanze tromboemboliche (vedi
Par. 7.3.1h). La riduzione della
concentrazione plasmatica della proteina legante la vitamina D (group component,
vedi Par. 10.9d) può concorrere
alle anomalie del metabolismo del calcio osservate in questi casi.
Diminuisce anche l’attività della lecitina-colesterolo
aciltransferasi e della lipoproteina lipasi (Par. 3). Di converso
aumentano cospicuamente nel plasma altre proteine come l’α2-macroglobulina, l’aptoglobina,
le pre-β-lipoproteine e le β-lipoproteine (con marcato aumento del
colesterolo e dei trigliceridi plasmatici), probabilmente per una
aumentata sintesi epatica compensatoria.
).
Si può avere inoltre ipotransferrinemia e, per superamento della
capacità proteinosintetica delle plasmacellule,
ipogammaglobulinemia. La concentrazione dell’antitrombina
III si riduce concomitantemente all’albumina con aumento del
rischio di complicanze tromboemboliche (vedi
Par. 7.3.1h). La riduzione della
concentrazione plasmatica della proteina legante la vitamina D (group component,
vedi Par. 10.9d) può concorrere
alle anomalie del metabolismo del calcio osservate in questi casi.
Diminuisce anche l’attività della lecitina-colesterolo
aciltransferasi e della lipoproteina lipasi (Par. 3). Di converso
aumentano cospicuamente nel plasma altre proteine come l’α2-macroglobulina, l’aptoglobina,
le pre-β-lipoproteine e le β-lipoproteine (con marcato aumento del
colesterolo e dei trigliceridi plasmatici), probabilmente per una
aumentata sintesi epatica compensatoria.
La patogenesi del danno glomerulare non è riconducibile ad un unico meccanismo. Assume tuttavia una particolare importanza la presenza di anticorpi diretti contro sostanze estranee al rene o contro componenti proprie del nefrone. Fattori estrinseci al rene possono essere di natura batterica (endocardite batterica subacuta, infezioni streptococciche) o coinvolgere antigeni presenti in altri tessuti dell’organismo (ad esempio nel lupus eritematoso sistemico) e portare alla formazione di immunocomplessi che rimangono imbrigliati nelle strutture glomerulari. Una componente propria del nefrone, che può essere interessata al legame con anticorpi specifici, è la membrana basale glomerulare. Una classificazione delle principali glomerulopatie è riportata in Tab. 11.II.
| Tab. 11.II. Classificazione delle principali glomerulopatie | |
| Malattie primitive renali
|
|
| Glomerulonefrite a lesioni minime | |
| Glomerulonefrite focale segmentale | |
| Glomerulonefrite membranosa | |
| Glomerulonefrite proliferativa | |
| Glomerulopatie in malattie sistemiche | |
| Amiloidosi
|
|
| Nefropatia diabetica | |
| Lupus eritematoso
sistemico
|
|
| Porpora di Schönlein-Henoch
|
|
Con il termine di "proteinurie isolate" si indica un gruppo di condizioni caratterizzate da proteinuria di modesta entità in individui apparentemente sani al momento dell’esame. In rapporto alla postura le proteinurie isolate si classificano in transienti ortostatiche (70-80% dei casi) se sono presenti occasionalmente in ortostatismo, fisse ortostatiche (15-20% dei casi) se sono presenti costantemente in ortostatismo e costanti (5-10% dei casi) se sono presenti sia in orto- che in clinostatismo. Le proteinurie transienti ortostatiche sono del tutto benigne. Le proteinurie fisse ortostatiche si associano nel 10 % dei casi ad anomalie istologiche renali, ma hanno una prognosi benigna. Le proteinurie costanti si associano nel 40-70 % dei casi ad alterazioni istologiche renali, ma solo una minima parte dei soggetti sviluppa, dopo molti anni, una insufficienza renale.
Aumenti da cinque a cento volte dell’escrezione urinaria di proteine (albumina, transferrina, immunoglobuline) sono osservabili fino a dopo tre ore da una attività fisica intensa e sono probabilmente dovuti ad una transiente ischemia renale, responsabile di una proteinuria mista glomerulo-tubulare. Un aumento della escrezione urinaria di albumina è osservabile anche dopo un pasto ad alto contenuto proteico, mentre i valori più bassi di proteinuria si ottengono nei campioni di urine del primo mattino dopo una notte di riposo in clinostatismo. L’eliminazione di albumina non varia nei primi mesi di gravidanza, ma può moderatamente aumentare nel terzo trimestre probabilmente per un incremento della permeabilità glomerulare.
11.2c. Protenuria tubulare
Una proteinuria generalmente modesta (inferiore ai 2 g nelle
24 ore) può essere osservata quando vi è un ridotto
riassorbimento nel tubulo prossimale delle proteine a basso peso
molecolare, che sono normalmente filtrate dal glomerulo, come ad
esempio le microglobuline (l’α1-microglobulina,
l’α2-microglobulina,
la β2-microglobulina;
Par. 8.4), l’orosomucoide
(Par. 8.2.3) e
il lisozima ![]() . Questo tipo di proteinuria è di comune
riscontro nelle nefropatie tubulo-interstiziali (o interstiziali),
tuttavia in molti casi il danno può coinvolgere sia i glomeruli
che i tubuli. Una classificazione delle principali nefropatie
tubulo-interstiziali è riportata in Tab. 11.III.
. Questo tipo di proteinuria è di comune
riscontro nelle nefropatie tubulo-interstiziali (o interstiziali),
tuttavia in molti casi il danno può coinvolgere sia i glomeruli
che i tubuli. Una classificazione delle principali nefropatie
tubulo-interstiziali è riportata in Tab. 11.III.
| Tab. 11.III. Principali cause di nefropatia tubulo-interstiziale | |
| Farmaci | |
| Metalli pesanti | |
| Ostruzioni delle vie urinarie | |
| Malattie metaboliche | |
| deficit di vitamina D | |
| iperuricemia (Par. 4.1.1) | |
| ipercalcemia (Par. 12.4) | |
| tirosinemia
|
|
| intolleranza ereditaria
al fruttosio
|
|
| galattosemia
|
|
| cistinosi
|
|
| anemia drepanocitica (Par. 7.2.1a) | |
| acidosi tubulare
renale
|
|
| sindrome di Lowe
|
|
| Infezioni | |
| infezioni delle vie urinarie | |
| infezioni sistemiche | |
| Malattie neoplastiche | |
| Malattie immunologiche | |
I tubuli renali sono facilmente esposti ai danni da farmaci e
da sostanze tossiche che si accumulano nel loro lume e nella
midollare renale in conseguenza dei processi che portano alla
concentrazione dell’urina. Gli antibiotici aminoglicosidici
si legano ai fosfolipidi delle membrane cellulari. Farmaci
analgesici come la fenacetina o il suo metabolita paracetamolo si
combinano con le proteine cellulari diminuendo nel contempo le
scorte di glutatione. I farmaci antinfiammatori non steroidei (FANS)
inibiscono la sintesi delle prostaglandine vasodilatatrici renali
dando luogo ad ischemia. I metalli pesanti si combinano con i
gruppi sulfidrilici delle membrane cellulari alterandone la
permeabilità. Il cadmio è assorbito dai tubuli come
metallotioneina, una forma complessata ad alta tossicità. Una
proteinuria tubulare è stata descritta in caso di intossicazione
acuta da piombo o da sali di mercurio. Lesioni renali possono
essere causate dall’accumulo di rame e dall’ingestione
di cromo, arsenico o bismuto. Nefropatie interstiziali acute o
croniche possono essere inoltre espressione di processi
infiammatori di natura infettiva o immunologica. Una proteinuria
tubulare associata a difetti di riassorbimento con perdita di
acqua, sali minerali, urato, aminoacidi e glucosio, può far
parte della sindrome di Fanconi-De Toni-Debré
![]() primitiva o secondaria ad altri disordini metabolici congeniti od
acquisiti.
primitiva o secondaria ad altri disordini metabolici congeniti od
acquisiti.
11.2d. Protenuria secretoria o di origine tessutale
In condizioni di flogosi a carico delle vie escretrici può
aumentare la secrezione delle proteine che si originano nel
tratto urinario (per la maggior parte uromucoide e in minor parte
IgA). Come marcatori di danno tessutale possono essere dosate
nell’urina l’α-glicosidasi,
l’N-acetil-β-glicosaminidasi, l’alanina
aminopeptidasi e l’esterasi leucocitaria. L’α-glicosidasi, localizzata prevalentemente
in corrispondenza dei tubuli renali, è espressione, nelle urine,
del rinnovamento fisiologico dell’epitelio tubulare ed
aumenta ogniqualvolta si verifica una distruzione di questo
tessuto. L’N-acetil-β-glicosaminidasi
è particolarmente abbondante nelle cellule del tubulo prossimale
ed è presente sotto forma di due isoenzimi diversi, uno acido e
l’altro basico. Nell’urina normale si ritrova il solo
isoenzima acido, mentre in condizioni patologiche si rinvengono
entrambi gli isoenzimi. L’alanina aminopeptidasi è presente
nell’orletto a spazzola delle cellule tubulari prossimali
![]() .
La sua eliminazione urinaria aumenta precocemente nel danno
tubulare da antibiotici aminoglicosidici. L’esterasi
leucocitaria aumenta in presenza di una infezione urinaria.
.
La sua eliminazione urinaria aumenta precocemente nel danno
tubulare da antibiotici aminoglicosidici. L’esterasi
leucocitaria aumenta in presenza di una infezione urinaria.
11.2.1. Metodi di determinazione
Il metodo più comunemente usato per una valutazione qualitativa della proteinuria è quello che utilizza delle strisce reattive impregnate con un tampone citrato a pH 3,0 e un indicatore, il blu di bromofenolo, il cui viraggio da giallo, al verde e fino al blu è grossolanamente proporzionale alla concentrazione proteica (Par. 8.7.1c). Il metodo, che è più sensibile all’albumina che ad altre proteine, è idoneo per rivelare una proteinuria glomerulare ma è sconsigliato nel caso di una proteinuria di Bence Jones.
Le proteine urinarie possono essere dosate in modo quantitativo utilizzando gli stessi reagenti descritti per le protetine totali del siero (Par. 8.7.1b). La determinazione della proteinuria presenta tuttavia numerosi problemi dovuti alle ampie variazioni quantitative e qualitative e alla presenza di metaboliti, sali con diversa solubilità ed eventualmente farmaci e mezzi di contrasto. Per allontanare sostanze interferenti, è possibile precipitare le proteine, compreso l’uromucoide, con una soluzione contenente acido cloridrico, acido fosfotungstico ed etanolo (reattivo di Tsuchiya). Le tecniche nefelometriche e turbidimetriche sono comunemente usate per la determinazione quantitativa di proteine specifiche.
L’elettroforesi (su gel di poliacrilamide, gel di agarosio o acetato di cellulosa) permette generalmente lo studio della proteinuria glomerulare, ma non è adatta quando la concentrazione delle proteine è bassa. In tal caso è opportuno associare all’elettroforesi l’immunofissazione con antisieri specifici.
11.2.2. Preparazione del campione ed intervalli di riferimento
La β2-microglobulina è instabile nelle urine a pH inferiore a 6,0 e nelle urine dei pazienti in trattamento con gentamicina (un antibatterico aminoglicosidico), tuttavia può essere degradata anche a pH neutro o alcalino dagli enzimi rilasciati dai neutrofili in corso di piuria. Per ridurre la degradazione è utile somministrare alcali al paziente prima e durante la raccolta delle urine (4 g di bicarbonato di sodio la sera precedente la raccolta ed altri 4 g in 4 dosi nel giorno successivo). L’α1-microglobulina e l’α2-microglobulina sono stabili nell’urina. Per ricercare la proteina di Bence Jones, le urine devono essere concentrate almeno 10 volte se la proteinuria è inferiore a 200 mg/L.
La quantità e la composizione delle proteine nelle urine sono fondamentalmente determinate dalla interrelazione tra la filtrazione glomerulare e il successivo riassorbimeto tubulare. Gli individui normali presentano una escrezione urinaria giornaliera di 20-80 mg di proteine. Le proteine sono rappresentate per circa la metà da albumina, da tracce di proteine plasmatiche a basso peso molecolare e per il resto da uromucoide. In condizioni normali l’eliminazione giornaliera di β2-microglobulina è di 0,1 mg.
11.3. APPENDICE: NEFROLITIASI E CRISTALLURIA
L’organismo concentra l’urina, che deve essere escreta, per poter conservare la propria riserva d’acqua, ma ciò comporta che alcune sostanze relativamente poco solubili possano facilmente raggiungere una condizione di sovrasaturazione, specie quando la loro eliminazione aumenta o vi è un pH sfavorevole. Tuttavia per la presenza di inibitori della cristallizzazione (alcune glicoproteine, il citrato, etc.) la formazione di cristalli nell’urina è più lenta che nelle semplici soluzioni saline.
La maggior parte dei calcoli renali è formata da sali di
calcio (fosfato di calcio, ossalato di calcio e loro combinazioni).
I calcoli di fosfato di calcio sono generalmente dovuti ad una
ipercalciuria (in circa il 30% dei pazienti) o ad una urina con
pH per qualche ragione troppo elevato. In alcuni pazienti l’ipercalciuria
è accompagnata ad ipercalcemia dovuta molto spesso a un
iperparatiroidismo primario (vedi Par. 12.4). In altri pazienti normocalcemici, l’ipercalciuria
è spesso primitiva ![]() o, più raramente, secondaria (aumento di
attività della vitamina D, acidosi tubulare renale
o, più raramente, secondaria (aumento di
attività della vitamina D, acidosi tubulare renale
![]() ,
eccesso di attività glicocorticoide, morbo di Paget
,
eccesso di attività glicocorticoide, morbo di Paget
![]() ,
immobilizzazione prolungata, terapia cronica con furosemide
,
immobilizzazione prolungata, terapia cronica con furosemide
![]() ).
I calcoli di ossalato di calcio sono invece dovuti ad una
iperossaluria primaria
).
I calcoli di ossalato di calcio sono invece dovuti ad una
iperossaluria primaria ![]() o secondaria ad un aumento dell’apporto
dietetico
o secondaria ad un aumento dell’apporto
dietetico
![]() o dell’assorbimento intestinale dell’ossalato
o dell’assorbimento intestinale dell’ossalato
![]() .
Altre cause di iperossaluria sono un avvelenamento con glicole
etilenico o una eccessiva assunzione di vitamina C.
.
Altre cause di iperossaluria sono un avvelenamento con glicole
etilenico o una eccessiva assunzione di vitamina C.
I calcoli di triplofosfato sono composti prevalentemente da fosfato di ammonio e magnesio (struvite) e si formano in presenza di elevate concentrazioni di ammoniaca, ossia quando vi è una flora batterica (Proteus, Klebsiella, Pseudomonas) capace di degradare l’urea. Questi calcoli sono più frequenti nelle donne e possono associarsi ad altre forme di litiasi renale.
Difetti del metabolismo purinico, descritti nel Par. 4.1, portano alla formazione di calcoli di acido urico o suoi sali (nella gotta primitiva o secondaria e nell’ipouricemia ereditaria renale), di xantina (nella xantinuria ereditaria) o di 2,8-diidrossiadenina (nel defict di adenina fosforibosiltransferasi). La precipitazione delle purine è favorita da valori bassi di pH.
Calcoli di cistina possono formarsi in pazienti affetti da cistinuria. Questo è un difetto ereditario autosomico relativamente comune (negli screening neonatali la prevalenza è circa di 1:7000) dovuto ad una alterazione dei meccanismi di trasporto della cistina e degli aminoacidi diamino monocarbossilici (lisina, ornitina, arginina) che interessa sia il tubulo renale che l’intestino. Nell’eterozigote l’eliminazione di questi aminoacidi è superiore alla norma, ma inferiore rispetto all’omozigote.
11.3.1. Esame del sedimento urinario
L’esame della cristalluria microscopica come spia di un rischio di calcolosi si è rivelato di utilità limitata. Infatti molti dei cristalli che si ritrovano nel sedimento urinario non sono presenti al momento della minzione, ma si formano successivamente, quando le modificazioni del pH e della temperatura favoriscono la precipitazione dei soluti urinari. Per questo motivo, non si attribuisce alcun significato alla presenza di cristalli in urine esaminate a freddo, ma si dà valore solo ad un riscontro ripetuto di cristalli nelle urine appena emesse, specie se di grandi dimensioni, aggregati o di composizione particolare. Fanno eccezione a questa regola soltanto alcuni cristalli, come quelli di cistina, la cui presenza anche nelle urine conservate ha sempre un significato patologico.
Nel sedimento urinario i fosfati si presentano con un aspetto pulvirulento (fosfati amorfi) o cristallino (fosfato di calcio e fosfato di ammonio e magnesio). I fosfati amorfi e quelli di ammonio e magnesio sono caratteristici di urine alcaline.
I cristalli di carbonato di calcio possono presentarsi in granuli amorfi, in ammassi aghiformi o come sferoidi talora accoppiati a manubrio. Si sciolgono in acido acetico formando bollicine di CO2 e sono tipici di urine alcaline, in genere fermentate
I cristalli di ossalato di calcio diidrato hanno generalmente forma bipiramidale (a busta di lettera), mentre i cristalli di ossalato di calcio monoidrato hanno spesso l’aspetto di dischi biconcavi. Quando le urine sono ricche di questi cristalli assumono un colore biancastro. I cristalli sono solubili in acido cloridrico.
I cristalli di acido urico sono facilmente osservabili in urine acide, per cui il loro ripetuto rinvenimento anche in urine conservate sottolinea l’esistenza di un pH urinario abitualmente basso che può predisporre alla precipitazione in vivo. I cristalli di acido urico hanno un notevole polimorfismo e sono generalmente di colore giallo o bruno rossastro. Il loro riconoscimento è facilitato dalla positività al test della muresside (il precipitato assume un colore giallo arancio dopo aggiunta di acido nitrico a caldo e un colore violetto carico dopo una successiva aggiunta di alcali).
I cristalli di cistina sono presenti solo in urine acide ed hanno una forma esagonale molto regolare. Sono solubili in acido cloridrico, ma non in acido acetico.
11.3.1a. Osservazioni al microscopio ottico
|
|
|||
|
|
||
|
|
|
||
|
|
||
|
|
||
|
|
||
|
|
|
||
|
|
||
|
|
||
|
|
||
|
|
|
||
|
|
| aggiornamento: 22/02/12 |
