|
|
Costantino Salerno |
|
|
Appunti di Biochimica Clinica |
|
|
12. RICAMBIO IDRICO-SALINO
La regolazione fisiologica della composizione e della distribuzione del solvente acquoso nell’organismo è un processo omeostatico estremamente sensibile e complesso. Si distinguono due principali compartimenti idrici, il liquido intracellulare e il liquido extracellulare, quest’ultimo diviso ulteriormente in un compartimento intravascolare, in uno spazio interstiziale (che comprende la linfa) ed in un liquido transcellulare, del quale fa parte il liquido pleurico, pericardico, peritoneale e cerebrospinale. La composizione elettrolitica intracellulare è diversa da quella extracellulare in quanto nel primo compartimento predomina il potassio, mentre il secondo compartimento è essenzialmente una soluzione composta da sali di sodio (Tab. 12.I). La distribuzione dell’acqua corporea tra i principali compartimenti idrici dipende dalla pressione colloido-osmotica esercitata dalle particelle disciolte.
Tab. 12.I. Tipica composizione elettrolitica dei liquidi corporei |
||
citoplasma |
liquido extracellulare |
|
| Sodio | 5-8 mEq/L |
135-146 mEq/L |
Potassio |
140-150 mEq/L |
3,5-5,3 mEq/L |
Cloruri |
1-3 mEq/L |
100-110 mEq/L |
Calcio ionizzato |
0,1-1 μmol/L |
1,1-1,3 mmol/L |
Magnesio |
3-10 mmol/L |
0,7-1,0 mmol/L |
Fosfati inorganici |
1-1,3 mmol/L |
1-1,3 mmol/L |
12.1. SODIO
Circa il 44% del sodio dell’organismo
è contenuto nei liquidi extracellulari, il 47% nel tessuto osseo
![]() e solo il 9% all’interno delle cellule.
La funzione principale del sodio è quella di mantenere la
tonicità e il volume dei liquidi extracellulari. A tal fine
questo catione è attivamente pompato all’esterno
delle cellule e scambiato con il potassio per assicurare l’elettroneutralità del liquido
intracellulare.
e solo il 9% all’interno delle cellule.
La funzione principale del sodio è quella di mantenere la
tonicità e il volume dei liquidi extracellulari. A tal fine
questo catione è attivamente pompato all’esterno
delle cellule e scambiato con il potassio per assicurare l’elettroneutralità del liquido
intracellulare.
In condizioni normali vengono introdotti con la dieta 50-200 mEq di sodio al giorno in gran parte sotto forma di NaCl, mentre ne sono eliminati con le feci non più di 10 mEq. Anche con il sudore vengono eliminate piccole quantità di sodio che peraltro aumentano notevolmente in caso di sudorazione abbondante. L’escrezione del sodio è generalmente accompagnata dall’eliminazione di una corrispondente quantità di cloruri.
L’eliminazione urinaria di sodio è
largamente influenzata dal tipo di alimentazione, potendosi
rapidamente ridurre a tracce dopo 3-5 giorni di dieta priva di
questo catione. Il sodio attraversa liberamente i glomeruli
renali permettendo la formazione di una preurina isosmotica al
plasma. Circa 2/3 del sodio filtrato dai glomeruli viene
riassorbito a livello dei tubuli contorti prossimali assieme ad
una corrispondente quantità di cloruri e di acqua mediante un
processo attivo che funziona indipendentemente dalle necessità
dell’organismo (riassorbimento obbligatorio). Il
riassorbimento del sodio continua a livello della branca
ascendente dell’ansa di Henle, dove però l’acqua non viene riassorbita rendendo così ipotonico il
liquido endotubulare (vedi Par. 11).
A livello del tubulo distale e dei tubuli collettori viene
riassorbita la maggior parte del sodio residuo. In questa zona
del nefrone il riassorbimento del sodio avviene a spese degli
ioni K+ e H+ che vengono immessi nell’urina
e che competono fra loro nel processo di scambio con lo ione Na+:
in caso di acidosi prevale lo scambio con gli ioni H+
mentre in caso di alcalosi prevale lo scambio con gli ioni K+.
Inoltre, a differenza di quanto avviene nel tubulo contorto
prossimale, a livello del tubulo distale il riassorbimento è
facoltativo, cioè viene riassorbita una quantità variabile di
sodio in relazione alle necessità dell’organismo e sotto il
controllo ormonale. Il principale ormone che stimola il
riassorbimento del sodio è l’aldosterone, mentre il
desossicorticosterone è notevolmente meno attivo. Il cortisone e
il cortisolo hanno un’attività 1000 volte inferiore. Il
riassorbimento del sodio nei dotti collettori è inibito dai
peptidi natriuretici sintetizzati a livello cardiaco
![]() .
.
L’ipernatriemia (Tab. 12.II) può essere dovuta ad un deficit di acqua o ad un
accumulo di sodio nell’organismo. Una ipernatriemia da
deficit idrico accompagnata a sete si osserva in pazienti che non
sono in grado di introdurre acqua o sono affetti da
diabete insipido centrale o nefrogeno. Una scarsa introduzione di
liquidi per mancanza di sete (ipodipsia) può essere idiopatica o
dovuta a traumi, tumori primari o secondari, granulomi (per
esempio nella
sarcoidosi
o nella
istiocitosi)
o alterazioni vascolari a livello del sistema nervoso centrale. L’analogia
etiologica con le condizioni che causano un diabete insipido
centrale evidenzia la stretta contiguità nell’ipotalamo
degli osmocettori per il controllo della increzione dell’ormone
antidiuretico e di quelli per la sete. Un accumulo di sodio nell’organismo
si può avere con o senza edemi. Si osserva la prima condizione
nell’insufficienza cardiaca congestizia, nella sindrome
nefrosica ![]() , nell’epatopatie
croniche, nella gravidanza, durante il ciclo mestruale e nell’edema
idiopatico.
, nell’epatopatie
croniche, nella gravidanza, durante il ciclo mestruale e nell’edema
idiopatico.
Tab. 12.II. Principali cause di ipernatriemia |
||
| Deficit di acqua | con sete |
senza poliuria con poliuria (diabete insipido) |
| senza sete | idiopatico traumi tumori granulomi alterazioni vascolari |
|
| Eccesso di sodio | con edemi |
insufficienza
cardiaca congestizia sindrome nefrosica epatopatie croniche gravidanza e ciclo mestruale edema idiopatico |
| senza edemi | intossicazione
acuta da sodio eccesso di ormoni surrenalici (vedi Tab. 12.III) |
|
Un eccesso di sodio in assenza di edemi si ha in caso di un carico acuto di sodio in un soggetto impossibilitato ad accedere ai liquidi (lattante, anziano inabile) o quando vi sia una iperincrezione di ormoni surrenalici (in tal caso le manifestazioni cliniche sono legate principalmente all’ipertensione e all’ipopotassiemia). Una classificazione delle ipernatriemie da eccesso di ormoni surrenalici è riportata in Tab. 12.III (ulteriori informazioni sul metabolismo degli ormoni surrenalici sono riportate nel Par. 10.5).
Tab. 12.III. Ipernatriemie ipopotassiemiche da eccesso di ormoni surrenalici |
|
| Iperaldosteronismo
primario (iporeninemico) |
iperplasia adenoma carcinoma forma sopprimibile con glucocorticoidi |
| Iperaldosteronismo
secondario (iperreninemico) |
tumori renina-secernenti
(emoangiopericitoma benigno) ipertensione nefrovascolare ipertensione maligna |
| Eccesso di
glucocorticoidi (con attività mineralcorticoide) |
morbo di Cushing increzione ectopica di ACTH glucocorticoidi esogeni |
| Mineralcorticoidi esogeni | terapia con
mineralcorticoidi acido glicerrizico acido glicerretinico |
| Iperplasia surrenale congenita |
deficit di 11β-idrossilasi deficit di 17α-idrossilasi |
| Pseudoiperaldosteronismo | sindrome di Liddle
deficit di 11β-idrossisteroide deidrogenasi |
Una iponatriemia può essere iper-, ipo o
normovolemica a seconda che sia dovuta ad una emodiluizione o ad
un effettivo deficit di sodio accompagnato o indipendente da una
perdita d’acqua (Tab. 12.IV). L’iponatriemia da
diluizione è riconducibile ad una eccessiva introduzione di
liquidi (autondotta
![]() ,
psicogena, da annegamento in acqua dolce, iatrogena da
inappropriata somministrazione di liquidi per via endovenosa o
per irrigazione) o ad una insufficiente eliminazione renale di
acqua dovuta ad una eccessiva attività dell’ormone antidiuretico (per disfunzione dell’asse ipotalamo-ipofisi posteriore o increzione dell’ormone da parte di alcuni tumori, ad esempio il
carcinoma bronchiale a piccole celllule). Un deficit di sodio può
instaurarsi per cause prerenali o renali. Fra le perdite
prerenali, le forme di più frequente riscontro sono quelle
dovute a malattie gastroenteriche, malattie cutanee essudative,
ustioni o sudorazione eccessiva. Le perdite renali possono essere
primitive, come conseguenza di una nefropatia sale-disperdente (da
insufficienza renale o pielonefrite cronica, malattia cistica
midollare, nefropatia tossica), o apparire nella fase di
regressione dell’insufficienza renale acuta o di
normalizzazione del trapianto renale. Perdite renali di sodio
possono essere inoltre secondarie ad un ipoaldosteronismo
iperreninemico (malattia di Addison
,
psicogena, da annegamento in acqua dolce, iatrogena da
inappropriata somministrazione di liquidi per via endovenosa o
per irrigazione) o ad una insufficiente eliminazione renale di
acqua dovuta ad una eccessiva attività dell’ormone antidiuretico (per disfunzione dell’asse ipotalamo-ipofisi posteriore o increzione dell’ormone da parte di alcuni tumori, ad esempio il
carcinoma bronchiale a piccole celllule). Un deficit di sodio può
instaurarsi per cause prerenali o renali. Fra le perdite
prerenali, le forme di più frequente riscontro sono quelle
dovute a malattie gastroenteriche, malattie cutanee essudative,
ustioni o sudorazione eccessiva. Le perdite renali possono essere
primitive, come conseguenza di una nefropatia sale-disperdente (da
insufficienza renale o pielonefrite cronica, malattia cistica
midollare, nefropatia tossica), o apparire nella fase di
regressione dell’insufficienza renale acuta o di
normalizzazione del trapianto renale. Perdite renali di sodio
possono essere inoltre secondarie ad un ipoaldosteronismo
iperreninemico (malattia di Addison
![]() , iperplasia surrenale congenita o deficit di
corticosterone metilossidasi
, iperplasia surrenale congenita o deficit di
corticosterone metilossidasi
![]() , uso
di inibitori dell’enzima di
conversione dell’angiotensina), ad un
ipoaldosteronismo iporeninemico (invariabilmente associato ad una
insufficienza renale
, uso
di inibitori dell’enzima di
conversione dell’angiotensina), ad un
ipoaldosteronismo iporeninemico (invariabilmente associato ad una
insufficienza renale
![]() ), ad
uno pseudoipoaldosteronismo
), ad
uno pseudoipoaldosteronismo
![]() o
alla somministrazione di diuretici (furosemide, acido etacrinico).
o
alla somministrazione di diuretici (furosemide, acido etacrinico).
| Tab. 12.IV. Principali cause di iponatriemia | |||
| Da diluizione | eccessiva introduzione di liquidi | autoindotta psicogena annegamento iatrogena |
|
| insufficiente eliminazione di liquidi | disfunzione
neuroipofisaria tumori |
||
| Deficit di sodio | cause prerenali | malattie
gastroenteriche malattie cutanee essudative ustioni sudorazione eccessiva |
|
| cause renali | nefropatia
sale-disperdente fase di regressione di una insuff. renale ipoaldosteronismo iperreninemico ipoaldosteronismo iporeninemico pseudoipoaldosteronismo diuretici |
||
12.1.1. Metodi di determinazione
Il sodio può essere determinato mediante spettroscopia di emissione atomica (o di fiamma), spettroscopia di assorbimento atomico o elettrodi selettivi. La spettroscopia di assorbimento atomico ha una alta sensibilità, ma una bassa precisione e non è adatta per analisi di routine. Una determinazione potenziomentrica diretta del campione mediante un elettrodo selettivo può portare ad errore se non si tiene conto della diversa attività delle specie ioniche presenti nel campione e nel riferimento. Questo errore può essere evitato prediluendo il campione o modificando opportunamente la composizione del riferimento con la sostituzione di parte del cloruro con acetato.
12.1.2. Preparazione del campione ed intervalli di riferimento
Per la determinazione della sodiemia è possibile utilizzare
il siero, il plasma eparinizzato o il sangue intero eparinizzato.
E’ preferibile adoperare un sale di litio dell’eparina
in quanto il sale di sodio può falsare i risultati. Una
ipernatriemia spuria può essere dovuta ad un errore grossolano
nella raccolta del campione, quando ad esempio si effettua un
prelievo dallo stesso arto nel quale si sta somministrando una
soluzione ipertonica di sodio. Altre cause di errore possono
essere una contaminazione con sali di sodio dopo il prelievo o
una evaporazione dal campione. Una iponatriemia spuria può
essere invece dovuta ad un prelievo da un arto dove si sta
contemporaneamente infondendo una soluzione glucosata o ad una
contaminazione del campione con acqua. A meno che non si esegua
una determinazione potenziomentrica diretta del sodio mediante
elettrodi selettivi, è possibile incorrere in una sottostima
dell’analita (pseudoiponatriemia) se non si tiene conto del
volume plasmatico occupato dai lipidi e dalle proteine
![]() ,
specialmente in caso di ipertrigliceridemia endogena o esogena o
quando sono presenti delle paraproteine. L’intervallo
di riferimento per la sodiemia è di 135-145 mEq/L. L’eliminazione
giornaliera urinaria è di 50-200 mEq.
,
specialmente in caso di ipertrigliceridemia endogena o esogena o
quando sono presenti delle paraproteine. L’intervallo
di riferimento per la sodiemia è di 135-145 mEq/L. L’eliminazione
giornaliera urinaria è di 50-200 mEq.
12.2. POTASSIO
Il potassio è contenuto solo per circa il 2% nei liquidi extracellulari e per circa il 98% nello spazio intracellulare, per la maggior parte (il 75%) nelle fibrocellule muscolari. La differenza fra le concentrazioni nei settori intra- ed extracellulari è dovuta ad un processo attivo che richiede un apporto energetico. Anche il metabolismo endocellulare contribuisce ad accumulare il potassio nel citoplasma: infatti, per ogni grammo di azoto proteico sintetizzato vengono fissati all’interno delle cellule circa 3 mEq di potassio, mentre per ogni grammo di glicogeno sintetizzato ne vengono fissati circa 0,3 mEq. Il potassio non ha solo il compito di mantenere l’osmolarità dei liquidi intracellulari, ma possiede anche l’importante e specifica funzione di regolare l’eccitabilità delle fibrocellule muscolari.
Con l’alimentazione normale vengono introdotti giornalmente nell’organismo 50-150 mEq di potassio in quanto questo catione è contenuto in tutti i cibi di uso comune, anche se i più ricchi sono la frutta, i legumi ed i cereali. I vegetariani possono arrivare ad introdurre con gli alimenti fino a 1000 mEq di potassio al giorno senza alcun danno.
L’eliminazione del potassio con le feci è modesta (8-12 mEq al giorno), ma può aumentare notevolmente in condizioni patologiche per l’alta concentrazione di potassio nella saliva (circa 19 mEq/L) e nel succo gastrico (circa 9 mEq/L). Le perdite di potassio con il sudore sono trascurabili, salvo i casi di sudorazione molto profusa.
La principale via di eliminazione del potassio è costituita dai reni che hanno la capacità di adattarsi ad una aumentata introduzione di potassio con gli alimenti aumentandone l’escrezione ed evitando così un pericoloso accumulo nell’organismo. Tuttavia, a differenza di quanto accade per il sodio, se il soggetto è sottoposto ad una dieta a basso contenuto di potassio, l’escrezione giornaliera di questo catione può scendere a 10-20 mEq, ma non può ridursi a zero (eliminazione obbligatoria). Il potassio filtra a livello dei glomeruli renali in quantità corrispondenti alla sua concentrazione plasmatica, ma viene quasi totalmente riassorbito dal tubulo prossimale. Per essere eliminato, il potassio deve essere necessariamente scambiato con il sodio a livello del tubulo distale mediante un meccanismo regolato dagli ormoni mineralcorticoidi. Come già detto nel Par. 12.1, esiste una competizione fra gli ioni K+ e H+ nel processo di scambio con il sodio. Un deficit di cloro accentua la secrezione di potassio nel tubulo distale (vedi Par. 12.3).
Nonostante la sua prevalente posizione intracellulare, i disordini del metabolismo del potassio sono in genere identificati attraverso l’analisi del potassio extracellulare, piuttosto che attraverso la determinazione della quantità totale presente nell’organismo. Marcate alterazioni del potassio plasmatico possono così essere il risultato del movimento di questo elettrolita tra i compartimenti intra- ed extracellulari senza che vi sia uno stato di deplezione o di eccesso del catione.
Le principali cause di iperpotassiemia sono riportate in Tab. 12.V. Un passaggio del potassio dal
compartimento intracellulare a quello extracellulare può
osservarsi in caso di acidosi metabolica, carenza insulinica con
iperglicemia, danno tessutale acuto (esercizio fisico estenuante,
trattamento chemioterapeutico di neoplasie), somministrazione di
farmaci (succinilcolina, β-bloccanti
adrenergici) o paralisi periodica iperpotassiemica
![]() .
Una ritenzione di potassio nell’organismo può essere dovuta
ad una sua inappropriata somministrazione per via venosa, ad un
suo riassorbimento intestinale in pazienti con deviazione
chirurgica delle vie urinarie in un segmento digiunale
.
Una ritenzione di potassio nell’organismo può essere dovuta
ad una sua inappropriata somministrazione per via venosa, ad un
suo riassorbimento intestinale in pazienti con deviazione
chirurgica delle vie urinarie in un segmento digiunale
![]() ,
ad una sua diminuita eliminazione renale per grave compromissione
della filtrazione glomerulare, nefrite interstiziale con diretta
compromissione tubulare, uso di diuretici risparmiatori di
potassio (spironolattone, triamterene, amiloride),
ipoaldosteronismo iperreninemico (malattia di
Addison
,
ad una sua diminuita eliminazione renale per grave compromissione
della filtrazione glomerulare, nefrite interstiziale con diretta
compromissione tubulare, uso di diuretici risparmiatori di
potassio (spironolattone, triamterene, amiloride),
ipoaldosteronismo iperreninemico (malattia di
Addison ![]() , iperplasia surrenale
congenita o deficit di corticosterone metilossidasi
, iperplasia surrenale
congenita o deficit di corticosterone metilossidasi
![]() , uso di inibitori dell’enzima
di conversione dell’angiotensina),
ipoaldosteronismo iporeninemico
, uso di inibitori dell’enzima
di conversione dell’angiotensina),
ipoaldosteronismo iporeninemico
![]() o pseudoipoaldosteronismo
o pseudoipoaldosteronismo
![]() .
.
Tab. 12.V. Principali cause di iperpotassiemia |
||
| Ridistribuzione in vivo | acidosi metabolica carenza insulinica con iperglicemia danno tessutale acuto farmaci succinilcolina farmaci β-bloccanti adrenergici paralisi periodica familiare |
|
| Ritenzione | aumentata
somministrazione anastomosi delle vie urinarie con segmenti digiunali diminuita eliminazione renale |
diminuita filtrazione glomerulare nefrite interstiziale diuretici ipoaldosteronismo iperreninemico ipoaldosteronismo iporeninemico pseudoipoaldosteronismo |
Come è riassunto in Tab. 12.VI, un
incremento della captazione cellulare del potassio con
conseguente ipopotassiemia può aversi in caso di alcalosi,
aumento del bicarbonato plasmatico, dell’insulina o degli
agonisti β-adrenergici (adrenalina,
salbutamolo, fenoterolo) o intossicazione con toluene o sali
solubili di bario ![]() . Una ulteriore causa di alterata
distribuzione del potassio fra i compartimenti intra- ed
extracellulari è la paralisi periodica ipopotassiemica che può
avere carattere familiare
. Una ulteriore causa di alterata
distribuzione del potassio fra i compartimenti intra- ed
extracellulari è la paralisi periodica ipopotassiemica che può
avere carattere familiare
![]() o
essere associata a tireotossicosi
o
essere associata a tireotossicosi
![]() . Una deplezione di
potassio può avere cause extrarenali o renali. Fra le cause
extrarenali bisogna ricordare l’apporto inadeguato di
potassio in un soggetto con grave poliuria o una imponente
reticolocitosi postanemica e la perdita di potassio con una
sudorazione eccessiva o attraverso le feci (diarrea grave di
varia natura, apudomi
. Una deplezione di
potassio può avere cause extrarenali o renali. Fra le cause
extrarenali bisogna ricordare l’apporto inadeguato di
potassio in un soggetto con grave poliuria o una imponente
reticolocitosi postanemica e la perdita di potassio con una
sudorazione eccessiva o attraverso le feci (diarrea grave di
varia natura, apudomi ![]() , adenoma villoso del retto, impiego di
resine a scambio cationico). La cause renali sono classificate in
base al disordine acido-base che le accompagna. L’acidosi
renale ipopotassiemica può essere dovuta ad una acidosi renale
tubulare
, adenoma villoso del retto, impiego di
resine a scambio cationico). La cause renali sono classificate in
base al disordine acido-base che le accompagna. L’acidosi
renale ipopotassiemica può essere dovuta ad una acidosi renale
tubulare
![]() ,
ad una somministrazione di un inibitore dell’anidrasi
carbonica (acetazolamide) o ad una deviazione chirurgica delle
vie urinarie dalla vescica su un segmento intestinale
,
ad una somministrazione di un inibitore dell’anidrasi
carbonica (acetazolamide) o ad una deviazione chirurgica delle
vie urinarie dalla vescica su un segmento intestinale
![]() .
L’alcalosi ipopotassiemica renale può essere dovuta ad una
condizione di ipocloremia secondaria a vomito persistente, uso di
diuretici che agiscono sul segmento spesso del ramo ascendente
dell’ansa di Henle (furosemide, acido etacrinico) o sul
dotto collettore (tiazidi, clortalidone), abuso di lassativi,
diarrea cloro-disperdente familiare
.
L’alcalosi ipopotassiemica renale può essere dovuta ad una
condizione di ipocloremia secondaria a vomito persistente, uso di
diuretici che agiscono sul segmento spesso del ramo ascendente
dell’ansa di Henle (furosemide, acido etacrinico) o sul
dotto collettore (tiazidi, clortalidone), abuso di lassativi,
diarrea cloro-disperdente familiare
![]() , fibrosi cistica
, fibrosi cistica
![]() o mastocitosi sistemica secondaria a leucemia
basofila. Una alcalosi ipopotassiemica associata ad ipertensione
è generalmete dovuta ad un eccesso di attività
mineralcorticoide (vedi Tab. 12.III),
mentre una rara forma associata ad iperaldosteronismo
iperreninemico con soggetti normotesi si osserva nella sindrome
di Bartter
o mastocitosi sistemica secondaria a leucemia
basofila. Una alcalosi ipopotassiemica associata ad ipertensione
è generalmete dovuta ad un eccesso di attività
mineralcorticoide (vedi Tab. 12.III),
mentre una rara forma associata ad iperaldosteronismo
iperreninemico con soggetti normotesi si osserva nella sindrome
di Bartter ![]() . Una ipopotassiemia renale senza uno
specifico disordine acido-base si può avere per somministrazione
di farmaci (penicilline, cisplatino, aminoglicosidi) o nel caso
di leucemia mielomonocitica acuta con escrezione renale di
lisozima, remissione di una ostruzione delle vie urinarie,
necrosi tubulare acuta o deplezione di magnesio.
. Una ipopotassiemia renale senza uno
specifico disordine acido-base si può avere per somministrazione
di farmaci (penicilline, cisplatino, aminoglicosidi) o nel caso
di leucemia mielomonocitica acuta con escrezione renale di
lisozima, remissione di una ostruzione delle vie urinarie,
necrosi tubulare acuta o deplezione di magnesio.
| Tab. 12.VI. Principali cause di ipopotassiemia | ||
| Ridistribuzione in vivo | alcalosi aumento del bicarbonato plasmatico somministrazione di insulina agonisti β-adrenergici sostanze tossiche paralisi periodica ipopotassiemica |
familiare con tireotossicosi |
| Deplezione extrarenale | apporto inadeguato aumento delle perdite |
sudorazione eccessiva patologie gastroenteriche |
| Deplezione renale | acidosi ipopotassiemica | acidosi
tubulare renale inibitori dell’anidrasi carbonica deviazione chirur. delle vie urinarie |
| alcalosi ipopotassiemica | vomito
persistente diuretici lassativi diarrea cloro-disperdente familiare fibrosi cistica mastocitosi sistemica eccesso di orm. surr. (vedi Tab. 12.III) sindrome di Bartter |
|
| ipopotassiemie (senza un disordine acido-base) |
farmaci leucemia rimozione di ostruz. delle vie urinarie necrosi tubulare ac. in fase di diuresi deplezione di magnesio |
|
12.2.1. Metodi di determinazione
Il potassio può essere determinato mediante spettroscopia di emissione atomica (o di fiamma), spettroscopia di assorbimento atomico, elettrodi selettivi o metodi chimici. Una relativamente alta concentrazione di sodio può influenzare il grado di ionizzazione del potassio nella spettroscopia di emissione atomica, in particolare quando si adopera dell’urina. E’ possibile eliminare questo tipo di interferenza aggiungendo al campione un eccesso di un elemento facilmente ionizzabile, come il cesio. La spettroscopia di assorbimento atomico ha una alta sensibilità, ma una bassa precisione e non è adatta per analisi di routine. Una determinazione potenziomentrica diretta del campione mediante un elettrodo selettivo può portare ad errore se non si tiene conto della diversa attività delle specie ioniche presenti nel campione e nel riferimento. Questo errore può essere evitato prediluendo il campione o modificando opportunamente la composizione del riferimento con la sostituzione di parte del cloruro con acetato. Un metodo chimico per la determinazione del potassio si basa sulla misura turbidimetrica del complesso insolubile del catione con il tetrafenilborato. Un altro metodo utilizzabile su strisce reattive impiega uno ionoforo selettivo per il potassio che permette il trasferimento del catione dalla fase acquosa ad una matrice organica dove si lega ad un indicatore, il 7-(n-decil)-2-metil-4-(3’,5’-diclorofen-4’-one)-indonaftolo, che sprotonandosi cambia di colore.
12.2.2. Preparazione del campione ed intervalli di riferimento
Il campione di sangue va raccolto in eparina ed il plasma deve essere tempestivamente separato dalle cellule a temperatura ambiente. Non si devono adoperare dei sali d’ammonio dell’eparina in quanto gli ioni ammonio determinano una sovrastima del potassio quando si utilizzano elettrodi selettivi. Una iperpotassiemia spuria (o pseudoiperpotassiemia) può essere dovuta alla cessione del potassio dalle cellule al plasma in campioni di sangue intero conservato a 4°C anche in assenza di emolisi. In alcuni gruppi familiari questo fenomeno è più pronunciato, dando luogo alla psudoiperpotassiemia familiare, a causa di una maggiore sensibilità alla temperatura del sistema di controtrasporto Na+/K+ eritrocitario. Un’altra causa di psudoiperpotassiemia è una aumentata fragilità delle cellule che può riscontrarsi in pazienti leucemici o trombocitemici quando la conta degli elementi figurati è estremamente elevata. Una ipopotassiemia spuria può essere dovuta invece all’ingresso di potassio nelle cellule leucemiche di un paziente con un elevato numero di leucociti circolanti o negli eritrociti di un diabetico che ha ricevuto dell’insulina poco prima del prelievo, se il campioni di sangue sono lasciati per un certo tempo a temperatura ambiente.
L’intervallo di riferimento per la potassiemia è di 3,6-5,0 mEq/L. L’eliminazione giornaliera urinaria è di 30-90 mEq. Le conseguenze dell’iperpotassiemia di maggiore significato clinico sono a carico del cuore, in quanto si può avere un arresto cardiaco se il potassio plasmatico supera 8 mEq/L. Le alterazioni elettrocardiografiche si manifestano a concentrazioni più basse di potassio, in particolare se vi è iponatriemia, ipermagnesiemia o acidosi.
12.3. CLORURI
Il cloruro è il principale anione del compartimento extracellulare. La sua funzione è quella di accompagnare lo ione Na+ nei suoi spostamenti attraverso le membrane cellulari in modo di assicurare l’elettroneutralità del mezzo.
Il fabbisogno giornaliero di cloruri è di 70-270 mEq che vengono normalmente introdotti con gli alimenti sotto forma di NaCl. Il succo gastrico contiene elevate quantità di cloruri (150-200 mEq/L), ma nei liquidi dell’intestino tenue se ne trovano solo pochi in quanto, in condizioni normali, quasi tutti i cloruri secreti dalla mucosa gastrica vengono riassorbiti.
I cloruri filtrano liberamente attraverso i glomeruli renali per venire poi riassorbiti quasi completamente (circa il 99,4%) a livello dei tubuli prossimali e distali, seguendo passivamente il riassorbimento del sodio e del potasso. Poiché a livello distale il sodio può essere riassorbito anche per scambio con gli ioni K+ e H+, in questo distretto il riassorbimento dei cloruri si adatta alle necessità dell’organismo di mantenere costante il pH ematico.
Le modificazioni della cloremia nei disturbi
dell’equilibrio acido-base seguono, in direzione opposta, le
variazioni della concentrazione dei bicarbonati (vedi Par. 12.7a). A seconda delle
necessità i cloruri possono perciò essere ritenuti o eliminati
per via renale. Così nell’acidosi metabolica, in cui vi è
una diminuzione dei bicarbonati, vi è un aumento della cloremia,
mentre l’opposto si osserva in caso di alcalosi metabolica.
Viceversa, nell’acidosi respiratoria, dove vi è un aumento
dei bicarbonati, può aversi una riduzione dei cloruri nel
plasma, e nell’alcalosi respiratoria, dove i bicarbonati
diminuiscono, la cloremia si innalza
![]() .
.
Una ritenzione di cloruri può osservarsi in
certi casi di insufficienza renale acuta, nelle varie forme di
acidosi tubulare renale
![]() ,
nella disidratazione e nei pazienti trattati a scopo terapeutico
con alte dosi di cloruro d’ammonio o con inibitori dell’anidrasi
carbonica, enzima che riveste un ruolo importante nel processo di
acidificazione delle urine.
,
nella disidratazione e nei pazienti trattati a scopo terapeutico
con alte dosi di cloruro d’ammonio o con inibitori dell’anidrasi
carbonica, enzima che riveste un ruolo importante nel processo di
acidificazione delle urine.
Bassi valori di cloruri nel siero possono essere osservati, insieme ad una iponatriemia, nell’insufficienza surrenalica grave o in seguito al trattamento prolungato con diuretici mercuriali. Una diminuzione di cloruri si ha inoltre in vari tipi di acidosi metabolica per accumulo nel sangue di radicali acidi che possono sostituire il cloro nell’equilibrio degli elettroliti del compartimento extracellulare. Una deplezione di cloruri si osserva soprattutto in seguito a un vomito ripetuto ed abbondante (ad esempio per una stenosi pilorica); in questo caso, si osserva una alcalosi metabolica ipocloremica che si accompagna ad ipopotassiemia e ad urine nettamente acide, malgrado lo stato di alcalosi (aciduria paradossa).
12.3.1. Metodi di determinazione
I cloruri possono essere determinati con diversi metodi che si basano sulla proprietà degli ioni cloro di formare sali di mercurio o di argento indissociati. Gli ioni Cl- presenti nel campione possono essere così titolati con una soluzione di nitrato mercurico usando come indicatore il difenilcarbazone che forma con gli ioni Hg2+ un complesso colorato; questa tecnica, ancora in uso in alcuni laboratori, ha una precisione limitata in quanto richiede che l’operatore sia capace di individuare l’esatto momento della comparsa di un colore blu violetto a fine titolazione. In alternativa, i cloruri possono essere fatti reagire con il cloroanilato di mercurio liberando quantità stechiometriche di acido cloroanilico che può essere dosato spettrofotometricamente. Un altro metodo si basa sullo spostamento, ad opera dello ione Cl-, del CNS- dal tiocianato di mercurio e sulla formazione di complessi colorati rosso-mattone fra lo ione CNS- e lo ione ferrico attraverso delle reazioni che dipendono fortemente dalla temperatura. La bilirubina, l’emoglobina ed i lipidi possono interferire nel dosaggio.
Un metodo coulombometrico, utilizzato in alcuni apparecchi d’analisi, sfrutta la proprietà degli ioni Cl- di combinarsi con gli ioni Ag+ che vengono generati da un elettrodo d’argento in un campo elettrico a voltaggio costante. Quando si raggiunge il punto di equivalenza, compaiono in soluzione degli ioni Ag+ liberi che, depositandosi sul catodo, provocano una brusca variazione di corrente elettrica. Il tempo necessario per evidenziare il segnale, dopo che sono stati consumati tutti gli ioni Cl-, dipende dalla velocità con cui vengono liberati gli ioni Ag+ e da come è mescolata la soluzione. Se la concentrazione dei cloruri è molto alta (> 400 mEq/L), il cloruro d’argento precipitato può interferire sul segnale. L’aggiunta di gelatina o di alcool di polivinile ostacola la riduzione del cloruro d’argento sull’elettrodo di riferimento e facilita una deposizione uniforme dell’argento in eccesso. L’aggiunta di acido nitrico ed acido acetico impedisce la formazione di sali basici d’argento poco solubili assicurando nel contempo una buona conducibilità al mezzo.
Un’ulteriore metodica si basa sull’uso di elettrodi selettivi. La presenza di altre alidi può portare ad una sovrastima dei cloruri in maggiore o minore misura con tutte le procedure d’analisi. Di particolare importanza dal punto di vista clinico è l’eventuale presenza di bromuri per il frequente loro uso in terapia.
12.3.2. Preparazione del campione ed intervalli di riferimento
I cloruri possono essere determinati nel siero e nel plasma
eparinizzato, nelle urine ed in altri fluidi biologici. In ogni
caso è necessario separare rapidamente il liquido dagli elementi
figurati per evitare uno spostamento degli equilibri ionici
indotto dal metabolismo cellulare. La determinazione dei cloruri
nel sudore è importante per la diagnosi della fibrosi cistica
![]() .
Il test consiste nel provocare una sudorazione in una
zona circoscritta mediante l’impiego
di pilocarpina, la cui penetrazione nella cute è facilitata dall’applicazione di una corrente elettrica
continua. Il sudore è raccolto su un disco di carta assorbente
ed eluito in acqua distillata. Il saggio è attendibile solo se
la velocità di sudorazione è superiore a 1 g/(m2 x
min).
.
Il test consiste nel provocare una sudorazione in una
zona circoscritta mediante l’impiego
di pilocarpina, la cui penetrazione nella cute è facilitata dall’applicazione di una corrente elettrica
continua. Il sudore è raccolto su un disco di carta assorbente
ed eluito in acqua distillata. Il saggio è attendibile solo se
la velocità di sudorazione è superiore a 1 g/(m2 x
min).
L’intervallo di riferimento dei cloruri nel plasma è di 100-110 mEq/L. L’escrezione urinaria giornaliera è di 100-250 mEq. Una concentrazione di cloruri nel sudore superiore a 60 mEq/L è indicativa per una fibrosi cistica. E’ necessario tuttavia ripetere almeno due volte il test del sudore per confermare la diagnosi. Poiché i bambini sotto i 2-3 anni possono avere concentrazioni di elettroliti nel sudore particolarmente alte, è conveniente effettuare il saggio dopo questa età. Gli adulti hanno una composizione elettrolitica del sudore più variabile e possono presentare valori fino a 70 mEq/L.
12.4. CALCIO
Il calcio gioca un ruolo importante nell’organizzazione
strutturale del tessuto osseo
![]() (circa il 99% del
calcio di un individuo adulto è contenuto nello scheletro), ma
esercita altresì funzioni di regolazione metabolica
extracellulare ed intracellulare della massima importanza. Gli
ioni calcio diffondono liberamente in tutto lo spazio
extracellulare, dove la loro concentrazione è di circa 1,2 mmol/L
(circa il 99% del
calcio di un individuo adulto è contenuto nello scheletro), ma
esercita altresì funzioni di regolazione metabolica
extracellulare ed intracellulare della massima importanza. Gli
ioni calcio diffondono liberamente in tutto lo spazio
extracellulare, dove la loro concentrazione è di circa 1,2 mmol/L
![]() .
La concentrazione intracellulare del calcio è invece molto
inferiore (0,1-1 μmol/L). Questa bassa
concentrazione è necessaria affinché il calcio possa agire come
messaggero intracellulare ed è mantenuta mediante pompe del
calcio e scambiatori ionici sulla membrana citoplasmatica ed a
livello del reticolo endoplasmatico e dei mitocondri. Alcuni
enzimi (ad esempio la proteina-chinasi C) sono influenzati
direttamente dalla concentrazione del calcio nel citosol.
.
La concentrazione intracellulare del calcio è invece molto
inferiore (0,1-1 μmol/L). Questa bassa
concentrazione è necessaria affinché il calcio possa agire come
messaggero intracellulare ed è mantenuta mediante pompe del
calcio e scambiatori ionici sulla membrana citoplasmatica ed a
livello del reticolo endoplasmatico e dei mitocondri. Alcuni
enzimi (ad esempio la proteina-chinasi C) sono influenzati
direttamente dalla concentrazione del calcio nel citosol.
Nel plasma sanguigno la concentrazione del calcio totale è
circa due volte maggiore rispetto a quella del calcio ionizzato a
causa dei legami che questo contrae con le proteine, il fosfato,
il citrato e il bicarbonato. E’ tuttavia il calcio ionizzato
ad avere maggiore importanza fisiologica ed il suo livello è
soggetto a una rigorosa regolazione da parte dell’apparato
gastrointestinale, del rene e del tessuto osseo
![]() .
.
La principale fonte alimentare di calcio è costituita dal
latte e dai prodotti caseari, mentre il calcio delle verdure, pur
essendo in grosse quantità, è utilizzabile solo in parte. L’apporto
medio giornaliero di calcio con una dieta di tipo occidentale è
circa 20 mmol, ma di questi ne viene assorbito solo il 20-40%. L’assorbimento
dipende da due meccanismi. Il primo è un processo attivo
soggetto a saturazione che coinvolge una proteina legante il
calcio la cui sintesi aumenta per azione dell’1α,25(OH)2D (1α,25-diidrossi-vitamina
D o calcitriolo, vedi Par. 10.9d). Il trasporto attivo del calcio ha luogo nel
duodeno e nel digiuno prossimale. Il secondo meccanismo è
passivo ed avviene lungo tutto il tenue e, probabilmente, il
colon. L’assorbimento è prevalentemente attivo quando vi è
un basso contenuto di calcio negli alimenti, mentre l’assorbimento
passivo assume maggiore importanza in presenza di quote di calcio
più elevate. Bisogna comunque tenere presente che nell’intestino
il calcio non è solo assorbito, ma è anche escreto con i succhi
digestivi e che una parte del calcio endogeno (2-4 mmol al giorno)
non viene più riassorbita. Così, se l’apporto di calcio
con la dieta è molto basso (inferiore a 5 mmol al giorno) le
perdite intestinali di calcio possono superare la quota assorbita.
Anioni come il fosfato, l’ossalato e il fitato
![]() riducono la solubilità e quindi l’assorbimento del calcio.
riducono la solubilità e quindi l’assorbimento del calcio.
Il calcio plasmatico è filtrato dal glomerulo renale in ragione di circa 250 mmol nelle 24 ore. Circa il 98% del calcio filtrato è riassorbito: il 65% nel tubulo contorto prossimale mediante un processo attivo strettamente connesso con il riassorbimento del sodio e il rimanente nei successivi segmenti del nefrone. Comunque, solo la quota riassorbita nel tubulo contorto distale (circa il 10% del totale) è sottoposta ad una regolazione ormonale ad opera del paratormone che ne favorisce il passaggio dalla preurina al sangue. Altri fattori che influenzano positivamente il riassorbimento del calcio sono un aumento dell’apporto di sodio, l’ipovolemia e l’alcalosi. L’eliminazione urinaria del calcio è invece favorita da una dieta iperproteica, sia per la produzione di acidi dal metabolismo degli aminoacidi solforati, sia per la formazione di complessi del calcio con il solfato che ne impediscono il riassorbimento.
Nell’adulto, pur rimanendo costante la massa ossea, vi è un continuo scambio di calcio fra tessuto osseo e i liquidi extracellulari. Questo può essere dovuto ad un rimodellamento osseo o ad un processo di scambio del minerale senza modificazioni locali della matrice ossea. Al rimodellamento osseo sono da attribuire le modificazioni di densità ossea che si verificano con l’età o in condizioni patologiche. Il paratormone favorisce la mobilizzazione del calcio nelle ossa interagendo con recettori che si trovano sulle cellule della serie osteoblastica. Gli osteoblasti regolano a loro volta la funzione degli osteoclasti. L’1α,25(OH)2D è un potente fattore osteolitico in vitro favorendo la formazione di osteoclasti maturi, ma la sua importanza fisiologica sul riassorbimento osseo è incerta.
L’ipercalcemia insorge quando la quantità di calcio che
dall’osso e dall’intestino passa nel liquido
extracellulare eccede la capacità renale ad eliminarlo. Le cause
può comuni di ipercalcemia sono riportate in Tab. 12.VII. La causa più frequente di
ipercalcemia è l’iperparatiroidismo primario che ha una
prevalenza di circa 1:1000. Nel 90% dei casi esso è dovuto ad un
adenoma paratiroideo, mentre il carcinoma delle paratoroidi è
evidenziabile in meno dell’1% delle volte. Nei rimanenti
casi, l’iperparatiroidismo primario è riconducibile ad una
iperplasia di tutte e quattro le paratiroidi che talvolta può
far parte di una sindrome da neoplasia endocrina multipla di tipo
I
![]() .
Questa sindrome è responsabile della maggioranza dei casi di
iperparatiroidismo familiare. L’ipercalcemia ipocalciurica familiare è la
causa di circa il 2% delle ipercalcemie asintomatiche, ma può
presentarsi nel neonato con una ipercalcemia più seria che però
si risolve spontaneamente. L’ipercalcemia nelle neoplasie può
essere dovuta a metastasi che portano a una distruzione locale
del tessuto osseo
.
Questa sindrome è responsabile della maggioranza dei casi di
iperparatiroidismo familiare. L’ipercalcemia ipocalciurica familiare è la
causa di circa il 2% delle ipercalcemie asintomatiche, ma può
presentarsi nel neonato con una ipercalcemia più seria che però
si risolve spontaneamente. L’ipercalcemia nelle neoplasie può
essere dovuta a metastasi che portano a una distruzione locale
del tessuto osseo ![]() o all’immissione in circolo di
fattori che aumentano il riassorbimento osseo e/o diminuiscono l’eliminazione
renale del calcio, mimando l’azione del paratormone
o all’immissione in circolo di
fattori che aumentano il riassorbimento osseo e/o diminuiscono l’eliminazione
renale del calcio, mimando l’azione del paratormone
![]() .
Nelle malattie granulomatose (sarcoidosi, tubercolosi, lebbra, istoplasmosi, berilliosi) aumenta l’1α,25(OH)2D
per una idrossilazione del 25(OH)D da parte dei macrofagi; ciò
determina una ipercalciuria e, nei soggetti con compromissione
renale, una ipercalcemia. L’ipercalcemia può essere infine
conseguente ad una intossicazione da vitamina D, a un trattamento
dialitico prolungato o a un trapianto renale.
.
Nelle malattie granulomatose (sarcoidosi, tubercolosi, lebbra, istoplasmosi, berilliosi) aumenta l’1α,25(OH)2D
per una idrossilazione del 25(OH)D da parte dei macrofagi; ciò
determina una ipercalciuria e, nei soggetti con compromissione
renale, una ipercalcemia. L’ipercalcemia può essere infine
conseguente ad una intossicazione da vitamina D, a un trattamento
dialitico prolungato o a un trapianto renale.
| Tab. 12.VII. Cause più comuni di ipercalcemia | |
| Iperparatiroidismo primario | sporadico familiare |
| Ipercalcemia ipocalciurica familiare | |
| Malattie neoplastiche | malattie con lisi
ossea ipercalcemia umorale neoplastica |
| Malattie granulomatose | |
| Tossicità da vit. D o suoi derivati | |
| Trapianto renale | |
L’ipocalcemia è di meno frequente riscontro e può
essere dovuta a numerose cause (Tab.12.VIII).
Le cause più comuni di una ipocalcemia di una certa durata sono
da ricercarsi in una alterazione della sintesi, della increzione
o dell’attività del paratormone o dell’1a,25(OH)2D. Una forma molto
comune di ipoparatiroidismo è conseguente ad interventi
chirurgici sulla tiroide o su altre strutture del collo. Assai più
raro è l’ipoparatiroidismo idiopatico che può presentarsi
nella prima infanzia in associazione con l’assenza congenita
del timo (sindrome di Di George) o tra i 5 e i 10 anni,
generalmente associato ad altri deficit (come l’insufficienza
surrenalica, l’ipogonadismo, il diabete mellito e l’anemia
perniciosa) nella
sindrome autoimmunitaria plurighiandolare di tipo I,
che può presentarsi in forma sporadica o familiare. Altre forme
di ipoparatiroidismo sono dovute a mutazioni sul gene del
paratormone o su loci estranei a questo gene, ma che interessano
lo sviluppo embrionale, la struttura o la regolazione omeostatica
delle paratiroidi ![]() . Lo pseudoipoparatiroidismo è un gruppo
eterogeneo di rari difetti dovuti ad una resistenza periferica
all’azione del paratormone che si manifesta soprattutto a
livello renale
. Lo pseudoipoparatiroidismo è un gruppo
eterogeneo di rari difetti dovuti ad una resistenza periferica
all’azione del paratormone che si manifesta soprattutto a
livello renale ![]() . L’ipocalcemia può essere inoltre
dovuta ad alterazioni del metabolismo della vitamina D, per un
insufficiente apporto di precursori (deficit carenziale) o per
difetti congeniti od acquisiti di idrossilazione in posizione 1a nel rene, così come ad una resistenza
dell’organo bersaglio all’azione dell’1α,25(OH)2D. Altre cause di
ipocalcemie sono la liberazione in circolo di fattori capaci di
legarsi con consistenti quantità di calcio (acidi grassi nella
pancreatite acuta, fosfati nella rabdomiolisi, nella sindrome da
lisi tumorale e nell’infusioni o nelle ingestioni di
fosfati, citrato nelle trasfusioni di sangue o nell’infusione
di mezzi di contrasto), la presenza di metastasi osteoblastiche
diffuse o il marcato deficit di magnesio
. L’ipocalcemia può essere inoltre
dovuta ad alterazioni del metabolismo della vitamina D, per un
insufficiente apporto di precursori (deficit carenziale) o per
difetti congeniti od acquisiti di idrossilazione in posizione 1a nel rene, così come ad una resistenza
dell’organo bersaglio all’azione dell’1α,25(OH)2D. Altre cause di
ipocalcemie sono la liberazione in circolo di fattori capaci di
legarsi con consistenti quantità di calcio (acidi grassi nella
pancreatite acuta, fosfati nella rabdomiolisi, nella sindrome da
lisi tumorale e nell’infusioni o nelle ingestioni di
fosfati, citrato nelle trasfusioni di sangue o nell’infusione
di mezzi di contrasto), la presenza di metastasi osteoblastiche
diffuse o il marcato deficit di magnesio
![]() .
.
| Tab. 12.VIII. Cause più comuni di ipocalcemia | |
| Ipoparatiroidismo | da interventi
chirurgici o terapia radiante idiopatico sporadico idiopatico familiare |
| Pseudoipoparatiroidismo | |
| Alterazione del metabolismo della vit. D | |
| Resistenza alla vit. D | |
| Altre cause | |
12.4.1. Metodi di determinazione
La concentrazione totale del calcio può essere determinata con metodi che prevedono la sua separazione per precipitazione, l’uso di fluorofori, cromofori o tecniche di assorbimento atomico.
Il calcio può essere precipitato aggiungendo un eccesso di acido ossalico, acido naftilidrossamico o acido cloranilico. Il precipitato può essere quantizzato mediante aggiunta di permanganato di potassio nel primo caso, mediante aggiunta di nitrato ferrico dopo solubilizzazione in EDTA nel secondo caso, o mediante una determinazione spettrofotometrica diretta del cloranilato che si libera dopo aggiunta di EDTA al precipitato nel terzo caso. Tutti questi metodi sono poco sensibili e richiedono molto tempo per la loro esecuzione.
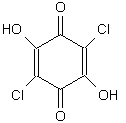
Fig. 12.1. Acido cloranilico
Il calcio può combinarsi con la calceina formando un complesso fluorescente titolabile mediante aggiunta di EGTA che, complessandosi con il calcio, determina una diminuzione del segnale proporzionale alla concentrazione dell’analita del mezzo.

Fig. 12.2. Calceina
L’o-cresolftaleina è frequentemente adoperata per misure spettrofotometriche dirette del calcio nel siero o nelle urine. Il prodotto di reazione è stabilizzato mediante aggiunta di cianuro di potassio. L’interferenza da ioni magnesio è eliminata aggiungendo dell’8-idrossichinolina (Fig. 12.5). L’emoglobina, le paraproteine ed i lipidi interferiscono nel dosaggio.
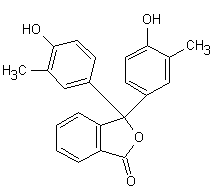
Fig. 12.3. o-Cresolftaleina
Un altro metodo spettrofotometrico si basa sulla formazione di un complesso colorato tra il calcio e l’arsenazo III. Questo colorante è generalmente adoperato in fase solida su lastrine a perdere mediante fotometria a riflessione.

Fig. 12.4. Arsenazo III
Le tecniche di assorbimento atomico permettono di determinare il calcio totale presente in campioni di siero o di urine, ma sono raramente usate nelle analisi di routine. Il calcio è dissociato dalle proteine in acido e dai fosfati, ossalati e citrati mediante aggiunta di ioni lantanio o stronzio. Nel calcolare la concentrazione del calcio, bisogna tener conto della contrazione di volume del campione dopo la precipitazione delle proteine.
Il calcio ionizzato può essere determinato mediante l’uso di elettrodi selettivi. Altre metodiche prevedono la separazione del calcio ultrafiltrabile (che comprende il calcio ionizzato ed i complessi del calcio a basso peso molecolare) mediante dialisi a flusso continuo o centrifugazione attraverso membrane semipermeabili. Il calcio nell’ultrafiltrato è dosato mediante tecniche chimiche e di assorbimento atomico.
12.4.2. Preparazione del campione ed intervalli di riferimento
La stasi venosa e la stazione eretta determinano un aumento della calcemia fino al 5-10%. La stasi venosa e il conseguente cambiamento di pH fanno inoltre variare il rapporto fra calcio ionizzato e calcio legato alle proteine. Il siero o il plasma devono essere rapidamente separati dalla frazione corpuscolata. Non sono accettabili i campioni resi incoagulabili con ossalato o EDTA. L’eparina a concentrazioni superiori a 20 U/mL diminuisce la quota di calcio ionizzato ed è perciò consigliabile in tal caso adoperare dell’eparina pre-titolata con calcio. Il calcio nelle urine può essere solubilizzato con aggiunta di acido cloridrico.
Poiché l’ipoalbuminemia è comune a molte condizioni patologiche di diversa natura, è indispensabile ricorrere alla determinazione del calcio ionizzato o almeno tenere conto della concentrazione plasmatica dell’albumina nella valutazione diagnostica di una ipocalcemia. I valori di riferimento per il calcio totale e ionizzato nel siero sono rispettivamente di 2,1-2,65 mmol/L e 1,14-1,31 mmol/L. La gravità della sintomatologia connessa ad una ipercalcemia dipende dalla sua entità e dalla rapidità con cui il calcio aumenta. Quando il calcio plasmatico è inferiore a 3 mmol/L i pazienti sono in gran parte asintomatici. L’eliminazione urinaria giornaliera di calcio è di 3-7 mmol.
12.5. MAGNESIO
Circa il 55% del magnesio presente nel corpo umano si trova
nella componente minerale del tessuto osseo, mentre circa il 45%
è localizzato all’interno delle cellule dove agisce come
cofattore in numerose reazioni enzimatiche che riguardano il
metabolismo energetico ![]() , la sintesi delle proteine e gli acidi
nucleici. Meno dell’1% del magnesio è invece presente nel
liquido interstiziale e nel plasma. Nel plasma, il magnesio è
per circa il 60% in forma ionizzata, per il 15% complessato con
fosfato, citrato e bicarbonato e per la quota restante legato
alle proteine.
, la sintesi delle proteine e gli acidi
nucleici. Meno dell’1% del magnesio è invece presente nel
liquido interstiziale e nel plasma. Nel plasma, il magnesio è
per circa il 60% in forma ionizzata, per il 15% complessato con
fosfato, citrato e bicarbonato e per la quota restante legato
alle proteine.
Il magnesio è diffusamente distribuito negli alimenti. La principale fonte è costituita dai vegetali a foglie verdi, ma una quota notevole è assunta con le acque minerali. L’apporto medio giornaliero di magnesio con la dieta è di 6-20 mmol. L’assorbimento avviene principalmente nell’intestino tenue sia mediante un processo di diffusione passiva sia per mezzo di un trasportatore attivo non dipendente dalla vitamina D e saturabile a basse concentrazioni di magnesio intraluminare. La quota di magnesio assorbita è maggiore (fino al 75%) quando la dieta è carente di magnesio, mentre è minore (fino al 25%) quando la dieta ne è più ricca. L’assorbimento è ostacolato da agenti complessanti come il fosfato di cellulosa. L’eliminazione di magnesio con le feci è generalmente attorno alle 15 mmol nelle 24 ore.
Il magnesio è filtrato dal glomerulo renale, ma è riassorbito per il 90-95% principalmente a livello del tubulo contorto prossimale e del tratto spesso della branca ascendente dell’ansa di Henle. Normalmente il rene ha una elevata capacità di eliminare il magnesio in eccesso, potendo far fronte nelle 24 ore fino ad un carico di circa 400 mmol. Il paratormone aumenta il riassorbimento tubulare del magnesio, ma non è di rilevante importanza nella regolazione complessiva del suo metabolismo. Cospicue perdite di magnesio possono avvenire tramite il sudore. A temperature elevate il 10-15% dell’eliminazione del magnesio avviene attraverso questa via.
L’omeostasi del magnesio è mantenuta da un equilibrio
tra assorbimento intestinale ed eliminazione renale. L’ipermagnesiemia
è generalmente un problema clinico limitato a pazienti con
insufficienza renale acuta o cronica e può essere dovuta ad un
eccessivo carico di magnesio mediante soluzioni per dialisi,
perfusioni o irrigazioni endoluminali o ad una liberazione di
magnesio dai tessuti. L’ipomagnesiemia può essere la
conseguenza di un inadeguato apporto o assorbimento di magnesio o
di una eccessiva perdita urinaria per un’alterazione
funzionale del tubulo renale. Alterazioni congenite sono l’ipomagnesiemia
primitiva familiare e l’ipomagnesiemia magnesiurica
familiare
![]() .
L’ipomagnesiemia può essere infine conseguente ad una
ridistribuzione del magnesio fra compartimenti extra- ed
intracellulari (dopo un infarto del miocardio o una
paratiroidectomia, nella fase di recupero della chetoacidosi
diabetica o di un digiuno prolungato e nella pancreatite acuta).
Spesso l’ipomagnesiema è associata ad ipocalcemia.
.
L’ipomagnesiemia può essere infine conseguente ad una
ridistribuzione del magnesio fra compartimenti extra- ed
intracellulari (dopo un infarto del miocardio o una
paratiroidectomia, nella fase di recupero della chetoacidosi
diabetica o di un digiuno prolungato e nella pancreatite acuta).
Spesso l’ipomagnesiema è associata ad ipocalcemia.
12.5.1. Metodi di determinazione
Il magnesio può essere determinato con metodi che prevedono la sua separazione per precipitazione, l’uso di fluorofori, cromofori o reazioni enzimatiche, tecniche di assorbimento atomico o di fotometria a fiamma.
Il magnesio può essere precipitato come fosfato di ammonio e magnesio, MgNH4PO4, misurabile con metodi gravimetrici. La metodica è relativamente imprecisa e non più usata nei laboratori.
Le metodiche che utilizzano fluorofori leganti il magnesio sono molto sensibili, ma generalmente danno una fluorescenza di base elevata. Inoltre la fluorescenza può venire inibita dal campione stesso (quencing). I fluorofori più comunemente usati sono la calceina e l’8-idrossichinolina.
Fig. 12.5. 8-Idrossichinolina
L’uso di cromofori dà migliori risultati. I più adoperati sono il blu di metiltimolo e la calmagite. Per inibire le interferenza da ioni calcio vengono aggiunti dei chelanti specifici di questo catione (EGTA), mentre il KCN è usato per impedire la formazione di complessi con i metalli pesanti. Un’altra metodica si basa sull’adsorbimento del colorante Titan yellow sulle micelle colloidali di idrossido di magnesio ottenute a pH alcalino; si sviluppa un colore rosso che è misurabile a 540 nm. Per evitare la precipitazione del complesso colloidale, viene aggiunto al campione dell’alcool di polivinile.
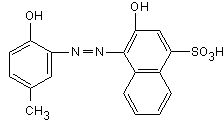
Fig. 12.6. Calmagite
Altre metodiche sfruttano il fatto che solo il complesso dell’ATP con il magnesio può essere substrato di alcuni enzimi. Un esempio di una metodica enzimatica di questo tipo è dato dalla sequenza di reazioni catalizzate dall’esochinasi e dalla glucosio 6-fosfato deidrogenasi. La velocità di formazione dell’NADPH viene misurata a 340 nm.

La determinazione del magnesio mediante assorbimento atomico dà una eccellente accuratezza nel risultato, mentre la fotometria a fiamma ha una scarsa sensibilità.
12.5.2. Preparazione del campione ed intervalli di riferimento
Il siero deve essere separato rapidamente dal coagulo per evitare la fuoriuscita di magnesio dai globuli rossi, dove è concentrato circa tre volte di più. Campioni emolizzati non possono essere accettati, così come campioni contenenti citrato, ossalato o EDTA che chelano gli ioni magnesio. Le urine devono essere acidificate a pH 1 con HCl.
I valori di riferimento nel siero sono 0,65 - 1,05 mmol/L. Una ipermagnesiemia di 1,5-2,5 mmol/L può accompagnarsi ad ipotensione, ma più frequentemente è asintomatica. Livelli di 2,5-5,0 mmol/L possono causare ariflessia ed alterazioni elettrocardiografiche. A livelli ancora più elevati sopravvengono paralisi respiratoria ed arresto cardiaco.
12.6. FOSFATI
Il fosforo è localizzato per la maggior parte (circa l’85%)
nelle ossa ![]() e nei denti e in misura minore (circa il
14%) all’interno delle cellule. Solo l’1% del fosforo
totale si trova nei liquidi extracellulari. Nel sangue è
presente sia in forma organica (fosfolipidi e fosfoproteine) che
in forma inorganica, come fosfato monobasico e dibasico (H2PO4-
e HPO42- nel rapporto di circa 1:4). Il 15-20%
del fosfato inorganico è combinato con legame non covalente con
le proteine plasmatiche.
e nei denti e in misura minore (circa il
14%) all’interno delle cellule. Solo l’1% del fosforo
totale si trova nei liquidi extracellulari. Nel sangue è
presente sia in forma organica (fosfolipidi e fosfoproteine) che
in forma inorganica, come fosfato monobasico e dibasico (H2PO4-
e HPO42- nel rapporto di circa 1:4). Il 15-20%
del fosfato inorganico è combinato con legame non covalente con
le proteine plasmatiche.
Nelle cellule, il fosforo organico è un componente fondamentale di un gran numero di molecole di importanza biologica come ad esempio i fosfolipidi delle membrane plasmatiche e degli organuli intracellulari, gli acidi nucleici, i cofattori enzimatici e gli intermedi della glicolisi e del metabolismo energetico.
Il fosfato inorganico è presente in circa uguale concentrazione (1-1,3 mmol/L) nel liquido extracellulare e all’interno delle cellule, dove viene trasportato attivamente contro un gradiente di potenziale. La concentrazione del fosfato inorganico citoplasmatico varia in risposta a variazioni del pool dei fosfati organici. L’accumulo di prodotti intermedi della glicolisi causa una marcata deplezione del fosfato inorganico citoplasmatico. A sua volta il fosfato svolge un ruolo importante nella captazione degli zuccheri e nella regolazione della glicolisi stessa e del livello di ATP. Negli eritrociti regola inoltre la concentrazione del 2,3-difosfoglicerato, che ha importanza critica per la cessione dell’ossigeno ai tessuti.
Il fosfato è diffuso in molti alimenti, cosicché se la dieta
è complessivamente equilibrata, lo è anche per quanto riguarda
questo composto. L’apporto medio giornaliero di fosfato con
una dieta di tipo occidentale è circa 45 mmol. Poiché la
capacità di adattamento a un ridotto apporto di fosfato è
considerevole, è difficile stabilire il fabbisogno dietetico
minimo. L’assorbimento procede attraverso due meccanismi. Il
primo è un meccanismo attivo, soggetto a saturazione, promosso
dall’1α,25(OH)2D (1α,25-diidrossi-vitamina D o calcitriolo, vedi
Par. 10.9d) ed
operante nel tratto digiunale. Il secondo è un processo passivo,
non saturabile, che interessa il digiuno e l’ileo e che
contribuisce all’assorbimento di circa il 67% del fosfato in
condizioni di adeguato rifornimento. Un elevato apporto di calcio
limita la biodisponibiltà del fosfato a causa della formazione
di complessi insolubili nel lume intestinale
![]() .
Circa 7 mmol di fosfato sono secrete ogni giorno nei succhi
digestivi.
.
Circa 7 mmol di fosfato sono secrete ogni giorno nei succhi
digestivi.
Il fosfato plasmatico è filtrato dal glomerulo renale, ma viene in gran parte riassorbito a livello del tubulo contorto prossimale (per circa il 75%) e a livello del tubulo contorto distale e del dotto collettore (per il 5-20%). L’assorbimento del fosfato nel tubulo contorto prossimale avviene contro un elevato gradiente elettrochimico, è accoppiato al trasporto attivo del sodio e viene inibito dal paratormone. Piccole quantità di fosfato (circa 1 mmol nelle 24 ore) possono essere perdute con il sudore.
Una iperfosfatemia può essere causata da una aumentata
immissione in circolo o da una diminuita eliminazione del fosfato.
Di rado il fosfato nella dieta è tale da determinare una
iperfosfatemia postprandiale, ma una eccessiva introduzione di
fosfati può avvenire con l’impiego di soluzioni di saline
per via endovenosa o per clistere. Una iperfosfatemia può essere
il risultato di una massiccia necrosi cellulare (nell’ipertermia
maligna, nel colpo di calore, nella rabdomiolisi o in corso di
una leucemia infantile sottoposta a chemioterapia), specie se vi
è una concomitante insufficienza della funzione renale in un
paziente in condizioni critiche. L’insufficienza renale può
essere di per se stessa causa di iperfosfatemia quando la velocità
di filtrazione glomerulare diviene inferiore a 30 mL/min. L’iperfosfatemia
può essere inoltre dovuta ad una diminuzione del paratormone
![]() ,
ad una insensibilità alla sua azione, ad una intossicazione da
vitamina D o ad una condizione di acromegalia
,
ad una insensibilità alla sua azione, ad una intossicazione da
vitamina D o ad una condizione di acromegalia
![]() o di tireotossicosi. Una malattia ereditaria che porta a
iperfosfatemia è la calcinosi tumorale
o di tireotossicosi. Una malattia ereditaria che porta a
iperfosfatemia è la calcinosi tumorale
![]() .
.
Una ipofosfatemia può essere dovuta al trasferimento acuto di
fosfato dal compartimento extracellulare alle cellule nel caso (1) di una rapida reintroduzione di alimenti in
un paziente con malnutrizione (per aumento della fosforilazione
del glucosio e del fruttosio e per la sintesi di ATP), (2) di una attività fisica intensa e prolungata
(per reintegrazione delle scorte di fosfocreatina) o (3) di una alcalosi respiratoria (per attivazione
della fosfofruttochinasi). Altre cause di ipofosfatemia sono l’iperparatiroidismo
primario, il deficit carenziale di vitamina D con
iperparatiroidismo secondario, il rachitismo ipofosfatemico
![]() ,
il diabete insulino-dipendente incontrollato
,
il diabete insulino-dipendente incontrollato
![]() ,
l’intossicazione con alcool o salicilati, l’uso di
simpaticomimetici b-agonisti.
,
l’intossicazione con alcool o salicilati, l’uso di
simpaticomimetici b-agonisti.
12.6.1. Metodi di determinazione
Il fosfato può essere dosato con metodi chimici o enzimatici.
Nel primo caso si fa reagire il fosfato con il molibdato, (NH4)6Mo7O24 , per formare dei fosfomolibdati complessi che possono essere misurati allo spettrofotometro direttamente a 340 nm o dopo riduzione a molibdeno blu a 660 nm. Come agenti riducenti sono stati usati l’idrossichinone, l’acido 1-amino-2-naftol-4-sulfonico, il solfato ferroso d’ammonio (NH4FeSO4) o il cloruro stannoso (SnCl2) stabilizzato con idrazina solfato.
La determinazione diretta dei fosfomolibdati complessi è ostacolata dal fatto che la reazione deve avvenire a pH acido per evitare la riduzione spontanea del molibdato, ma abbassando il pH la reazione rallenta. Poiché la reazione è più lenta in soluzioni acquose, è necessario aggiungere dell’albumina allo standard, ma l’albumina non è sempre esente da contaminazioni con fosfato. Quando come standard viene usato del siero, è necessario aggiungere un detergente (Tween 80) per eliminare la torbidità ed acidificare con acido solforico. Sieri itterici, lipemici o emolizzati falsano le misure. E’ utile in tali casi fare una doppia determinazione spettrofotometrica (a 340 nm ed a 380 nm) e sottrarre i due valori fra loro. La determinazione dei fosfomolibdati dopo riduzione a molibdeno blu presenta ulteriori problemi a causa dell’instabilità dei reagenti.
La determinazioe enzimatica si basa sulla sequenza di reazioni accoppiate catalizzate dalla nucleoside fosforilasi e dalla xantina ossidasi.

Il perossido di idrogeno è determinato in presenza di perossidasi e di un cromogeno opportuno (Par. 4.1.3b).
12.6.2. Preparazione del campione ed intervalli di riferimento
Il prelievo di sangue deve essere fatto a digiuno. Il globuli rossi devono essere rapidamente allontanati per evitare che del fosfato possa fuoriuscire dalle cellule. Una marcata emolisi nei campioni di plasma o di siero può causare un falso aumento della fosfatemia fino a circa il 30%.
Nel caso di una determinazione sull’urina, è conveniente acidificare il campione con HCl per evitare che il fosfato organico, presente in discreta quantità, possa decomporsi. Le urine devono essere generalmente diluite 1:10 prima dell’analisi.
Poiché il pH del mezzo influenza fortemente il rapporto fra le diverse specie chimiche presenti, la concentrazione del fosforo inorganico può essere espressa in termini di mg/L o mmol/L, ma mai in termini di mEq/L. I valori di riferimento per il siero sono riportati in Tab. 12.IX.
Tab. 12.IX. Valori di riferimento per il fosfato inorganico nel siero |
|
anni |
mmol/L |
< 1 |
1,0 - 2,4 |
2 |
1,1 - 1,9 |
10 |
1,0 - 1,9 |
20 |
0,7 - 1,5 |
30 |
0,7 - 1,5 |
La concentrazione plasmatica di fosfato varia considerevolmente con l’età. Valori più elevati sono riscontrabili nella prima infanzia, quando il soggetto è nel pieno della crescita. Nell’uomo adulto la fosfatemia inizia a diminuire dopo i 40 anni, mentre nella donna si osserva un modesto aumento dopo la menopausa. La fosfatemia non si modifica nel corso della gravidanza, aumentando invece significativamente durante l’allattamento. Nel corso della giornata, la fosfatemia è notevolmente più elevata di pomeriggio, mostrando un secondo picco nelle prime ore del mattino. La fosfatemia aumenta inoltre dopo i pasti per ridiscendere con l’attivazione della glicolisi stimolata dall’insulina.
12.7. EQUILIBRIO ACIDO-BASE
Il mantenimento della concentrazione di idrogenioni nel sangue e nei tessuti in ambiti appropriati è di vitale importanza per i processi metabolici dell’organismo. Il pH dei fluidi biologici è stabilizzato entro i limiti fisiologici da un insieme di sistemi tampone (bicarbonato, fosfato, proteinato), che garantiscono che la concentrazione degli idrogenioni rimanga pressoché invariata, nonostante vengano prodotti, nel corso del metabolismo cellulare, una elevata quantità di acidi fissi (acido solforico, acido fosforico, acido lattico, acido acetacetico) e volatili (acido carbonico).
Il bicarbonato (HCO3-) rappresenta il principale sistema tampone del sangue. In questo sistema tampone, il donatore di protoni, l’acido carbonico (H2CO3), è in equilibrio reversibile con l’anidride carbonica (CO2) disciolta nell’ambiente acquoso, la cui concentrazione è proporzionale alla pressione parziale di CO2 nella fase gassosa (pCO2). Di conseguenza, la concentrazione di idrogenioni nel sangue (H+) è proporzionale al rapporto tra la pressione parziale dell’anidride carbonica e la concentrazione degli ioni bicarbonato.
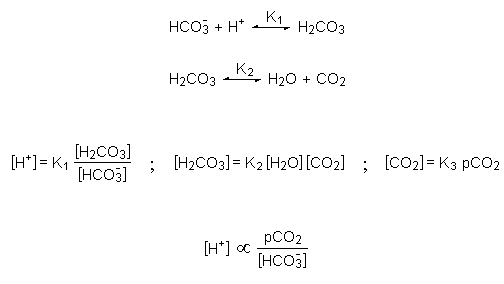
Pertanto, a parità di altre condizioni, l’aggiunta di idrogenioni, la rimozione di bicarbonato o l’aumento della pressione parziale dell’anidride carbonica avranno tutti il medesimo effetto, cioè l’aumento di [H+], mentre la rimozione di idrogenioni, l’aggiunta di bicarbonato o l’abbassamento della pressione parziale dell’anidride carbonica causeranno ugualmente un abbassamento di [H+].
L’associazione di idrogenioni al bicarbonato avviene rapidamente, mentre la dissociazione dell’acido carbonico ad anidride carbonica ed acqua è un processo piuttosto lento, che richiede l’intervento di un enzima, l’anidrasi carbonica, che è presente negli eritrociti e nei reni. Gli ioni H+, prodotti nel corso del metabolismo, sono efficacemente rimossi a spese del bicarbonato e l’anidride carbonica, che si forma, può essere espulsa nei polmoni. Gli ioni H+, che sono stati tamponati ad acido carbonico, possono essere inoltre escreti attraverso i reni (vedi Par. 12.1), rigenerando il bicarbonato usato durante il tamponamento in modo da mantenere inalterata la concentrazione del bicarbonato plasmatico. Gli ioni H+ escreti sono tamponati nell’urina dal fosfato e dall’ammoniaca.
Quando la funzione polmonare è compromessa, l’organismo tenta di aumentare l’escrezione di H+ attraverso la via renale (compensazione renale), mentre, quando vi sono dei disordini metabolici, sono i polmoni a cercare di ripristinare la normale concentrazione di idrogenioni (compensazione respiratoria).
Acidosi e alcalosi sono i termini clinici adoperati per definire i disturbi dell’equilibrio acido-base. Questi termini possono essere usati anche quando la concentrazione degli idrogenioni è all’interno dei valori di riferimento, cioè quando il disordine è totalmente compensato. L’alterazione dell’equilibrio acido-base è definita "metabolica" quando il disturbo primario è riconducibile ad una diminuzione o ad un aumento del bicarbonato. L’alterazione è definita "respiratoria" quando il disturbo primario è riconducibile ad un aumento o ad una diminuzione del pCO2. L’alterazione è di "tipo misto" quando è presente più di un disturbo dell’equilibrio acido-base.
Un altro parametro, che bisogna prendere in considerazione nella valutazione delle alterazioni dell’equilibrio acido-base, è il gap anionico, ossia la differenza tra la somma dei due principali cationi plasmatici (Na+ e K+) e la somma dei due principali anioni plasmatici (Cl- e HCO3-). Il gap anionico è espressione dei cosiddetti anioni non dosabili (proteine, fosfati, solfati, acidi organici) ed è utilizzato nella diagnosi differenziale delle acidosi metaboliche.
L’eccesso di basi è un valore espresso in mEq/L, che è utilizzato per quantificare un alterato livello ematico di basi ed è definito come la quantità di acido forte (o di base forte) che deve essere aggiunta ad un litro di sangue completamente ossigenato per riportarlo a pH 7,4 ad una temperatura di 37°C e ad una pCO2 di 40 mmHg. L’eccesso di basi assume un valore positivo in caso di un surplus di basi ed un valore negativo in caso di un deficit di basi. L’eccesso di basi effettivo è quello presente effettivamente nel sangue, mentre l’eccesso di basi standard è il valore ottenuto ad una concentrazione di emoglobina di 5 g/dL. Una variazione del livello di bicarbonato nel sangue generalmente si rispecchia in una analoga variazione dell’eccesso di basi, tuttavia l’eccesso di basi ha un significato più ampio in quanto tiene conto del contributo di tutte le specie ioniche coinvolte nella variazione di pH.
12.7a. Disordini di tipo metabolico
I disordini acido-base di tipo metabolico sono riconoscibili per una variazione della concentrazione del bicarbonato ed avvengono comunemente a causa di un aumento o una diminuzione di idrogenioni. Anche una perdita diretta o un eccesso di bicarbonato possono essere causa di disordini metabolici acido-base. Quando la concentrazione del bicarbonato diminuisce, altri anioni devono prendere il suo posto per mantenere la neutralità elettrochimica. Se il cloruro sostituisce il bicarbonato, il gap anionico non cambia. Il gap anionico invece aumenta quando vengono prodotti degli acidi (acidi lattico, acido acetacetico, acido solforico, etc.).
Acidosi metaboliche con gap anionico normale vengono
spesso indicate come "acidosi ipercloremiche", poiché la diminuita concentrazione
di HCO3- è bilanciata da una aumentata concentrazione di
Cl-. Questa forma di acidosi metabolica si osserva in caso di diarrea
cronica o di fistola intestinale per perdita di fluidi contenenti
bicarbonato oppure in caso di acidosi tubulare renale
![]() per incapacità delle
cellule tubulari di operare l’escrezione di idrogenioni con conseguente perdita
di bicarbonato con le urine.
per incapacità delle
cellule tubulari di operare l’escrezione di idrogenioni con conseguente perdita
di bicarbonato con le urine.
Acidosi metaboliche con gap anionico elevato si osservano in corso di chetoacidosi diabetica (per produzione endogena di acido acetacetico e β-idrossibutirrico), acidosi lattica (per stati apossici acuti, malattie epatiche), malattie renali (per ritenzione di anioni) o avvelenamenti (per somministrazione di salicilato, metanolo, glicole etilenico).
Alcalosi metaboliche sono conseguenti a perdita di
idrogenioni (per vomito incoercibile), assunzione di basi (per somministrazione
di grandi quantità di bicarbonato in pazienti con deficit renale), deplezione di
potassio (per somministrazione di diuretici,
![]() ).
).
La risposta compensatoria all’acidosi metabolica è l’iperventilazione, poiché il centro respiratorio è fortemente stimolato dall’aumento di idrogenioni ematici: il respiro diviene profondo, rapido e convulsivo (respiro di Kussmaul) ed aumenta il rischio di crisi aritmiche e di arresto cardiaco, a causa della concomitante iperpotassiemia (vedi Par 12.1). In caso di alcalosi metabolica, il quadro clinico è invece caratterizzato da ipoventilazione, confusione mentale e, infine, coma.
12.7b. Disordini di tipo respiratorio
Nei disordini acido-base di tipo respiratorio, il disturbo primario è causato da una variazione del pCO2 arteriosa.
L’acidosi respiratoria si accompagna generalmente ad una
riduzione della pressione parziale di ossigeno (pO2) nel sangue
arterioso
![]() e può
manifestarsi in forma acuta o cronica. L’acidosi acuta è conseguente a shock,
broncopolmonite o asma, può durare minuti od ore e non è compensata, poiché i
meccanismi che regolano il riassorbimento del bicarbonato a livello renale
richiedono 48-72 ore per diventare efficaci. L’acidosi respiratoria cronica
deriva in genere da una malattia ostruttiva cronica delle vie aeree (bronchite
cronica, enfisema) ed è accompagnata da compensazione renale.
e può
manifestarsi in forma acuta o cronica. L’acidosi acuta è conseguente a shock,
broncopolmonite o asma, può durare minuti od ore e non è compensata, poiché i
meccanismi che regolano il riassorbimento del bicarbonato a livello renale
richiedono 48-72 ore per diventare efficaci. L’acidosi respiratoria cronica
deriva in genere da una malattia ostruttiva cronica delle vie aeree (bronchite
cronica, enfisema) ed è accompagnata da compensazione renale.
L’alcalosi respiratoria è molto meno frequente dell’acidosi e può manifestarsi quando la respirazione è stimolata o quando non è più soggetta a un controllo di feedback. Esempi di alcalosi metabolica sono la respirazione forzata o isterica, l’iperventilazione meccanica in pazienti in terapia intensiva, la stimolazione del centro del respiro in caso di ipossia o di aumentata pressione intracranica.
12.7c. Disordini di tipo misto
Sono frequenti i casi di pazienti che hanno più di un disordine acido-base. Un paziente può avere sia acidosi respiratoria, sia acidosi metabolica (ad esempio, un paziente con bronchite cronica che sviluppa una insufficienza renale) oppure sia alcalosi respiratoria, sia alcalosi metabolica (ad esempio, un paziente in condizioni di iperventilazione con reflusso rinogastrico prolungato). In tutti questi casi, i risultati attesi sono quelli propri sia del disordine acido-base di tipo respiratorio che del disordine acido base di tipo metabolico (pCO2 alta e [HCO3-] bassa, in caso di acidosi; pCO2 bassa e [HCO3-] alta, in caso di alcalosi).
Se le due alterazioni dell’equilibrio acido-base sono di segno opposto, uno dei disordini può mimare una risposta compensatoria. In questi casi, tuttavia, la compensazione si trova al di fuori dei limiti attesi e, in ogni caso, la conoscenza del quadro clinico è dirimente nell’interpretazione dei dati di laboratorio. Ad esempio, un paziente può essere in acidosi respiratoria a causa di una ostruzione cronica delle vie aeree e, contemporaneamente, in alcalosi metabolica per deplezione di potassio da diuretici; oppure, in caso di avvelenamento da salicilato, un paziente può manifestare alcalosi respiratoria per stimolazione del centro del respiro e, contemporaneamente acidosi metabolica per l’effetto metabolico del farmaco.
12.7.1. Metodi di determinazione
I valori di [H+], pCO2 e pO2 sono determinati direttamente dall’emogasanalizzatore; il valore di [HCO3-] è desunto dai primi due in base alla legge di azione di massa. La concentrazione di bicarbonato può essere anche determinata direttamente come parte degli esami del profilo elettrochimico su un campione di siero ottenuto da sangue venoso. I risultati (descritti come "CO2 totale") non sono ovviamente identici a quelli provenienti dall’emogasanalizzatore, poiché comprendono anche la CO2 disciolta, l’acido carbonico e altri composti carbaminici, ma generalmente non differiscono di più di 3 mmol/L e possono essere interpretati in modo analogo.
12.7.2. Preparazione del campione ed intervalli di riferimento
Il sangue è normalmente prelevato dall’arteria brachiale o radiale con una siringa contenete un piccolo volume di eparina come anticoagulante. E’ importante eliminare l’aria dalla siringa prima e dopo il prelievo di sangue, prima che la siringa sia tappata per l’immediato trasporto al laboratorio. La siringa e il suo contenuto devono essere conservati in ghiaccio durante il trasporto.
La concentrazione di idrogenioni nel sangue è generalmente espressa in unità di concentrazione molare ed è compresa tra 35 e 45 nmol/L (ossia nell’intervallo di pH tra 7,35 e 7,46). I valori di riferimento degli altri parametri utilizzati in emogasanalisi sono riportati in Tab. 12.X.
|
Tab. 12.X. Valori di riferimento in emogasanalisi |
|
| idrogenioni (H+) | 35-45 nmol/L |
| pressione parziale di CO2 (pCO2) | 4,6-6,0 kPa |
| pressione parziale di O2 (pO2) | 10,5-13,5 kPa |
| bicarbonato (HCO3- ) | 21-28 mmol/L |
| gap anionico | 6-18 mmol/L |
| eccesso di basi | ±2 mEq/L |
| aggiornamento: 22/02/12 |