|
|
Costantino Salerno |
|
|
Appunti di Biochimica Clinica |
|
|
3. METABOLISMO LIPIDICO
Le lipoproteine costituiscono nel plasma una microemulsione di
particelle eterogenee risultanti dall’aggregazione dei
lipidi con specifiche proteine di trasporto (apolipoproteine). Le
micelle lipoproteiche sono generalmente sferiche e formate da un
guscio monostratificato di proteine e lipidi polari, in gran
parte fosfolipidi, racchiudente un nucleo centrale rappresentato,
a sua volta, da lipidi apolari, principalmente trigliceridi e
colesterolo esterificato. Il colesterolo non esterificato è
presente nel monostrato di superficie, ma all’aumentare
delle dimensioni della micella si distribuisce progressivamente
anche al suo interno
![]() .
.
La densità delle lipoproteine è in relazione inversa al diametro micellare medio, in quanto dipende dal rapporto fra lo strato proteico superficiale a più alta densità e il nucleo lipidico meno denso (queste due componenti variano, a loro volta, rispettivamente in funzione del quadrato e del cubo del diametro della particella). In base alla densità, alla composizione e alle proprietà funzionali, le lipoproteine sono generalmente divise in cinque classi principali (Tab. 3.I). Le due classi a più bassa densità (chilomicroni e VLDL) contengono principalmente trigliceridi nel loro nucleo centrale, mentre quote relativamente alte di colesterolo sono presenti nelle IDL e, principalmente, nelle due classi lipoproteiche a più alta densità (LDL e HDL). I chilomicroni, le VLDL e IDL (che rappresentano forme di passaggio fra le VLDL e le LDL) hanno una emivita notevolmente più breve rispetto le LDL e le HDL.
Tab. 3.I. Classificazione delle lipoproteine
Chilomicroni |
VLDL |
IDL |
LDL |
HDL |
|
| Caratteristiche fisiche | |||||
| diametro (nm) | 1200-75 |
80-30 |
35-25 |
25-18 |
12-5 |
| densità (g/L) | < 930 |
930-1016 |
1006-1019 |
1019-1063 |
1063-1210 |
| Composizione media (%) | |||||
| trigliceridi | 86 |
55 |
23 |
6 |
4 |
| colesterolo libero | 2 |
7 |
9 |
8 |
3 |
| colesterolo ester. | 3 |
12 |
29 |
42 |
16 |
| fosfolipidi | 7 |
18 |
20 |
22 |
27 |
| proteine | 2 |
8 |
19 |
22 |
50 |
| Emivita (ore) | 1 |
1-3 |
1-3 |
72-96 |
72-96 |
In base alla densità, le HDL sono divise in due gruppi
principali (HDL2 e HDL3, rispettivamente
con densità compresa tra 1063-1120 g/L e tra 1120-1210 g/L). Un
terzo gruppo (HDL1 o apo E-rich HDL) a densità
inferiore alle HDL2 è correlato alle HDLc
(riscontrate in animali da esperimento), la cui sintesi è
indotta dall’ingestione di colesterolo probabilmente per
facilitare il suo trasporto verso il fegato
![]() . Altre lipoproteine minori
sono le Lp(a) (sinking pre-ß lipoproteins), con densità
maggiore delle VLDL ma migranti assieme a queste
all’elettroforesi, e le lipoproteine-X, formate principalmente da
lecitina (67%), colesterolo (23%), albumina e apo C (6%) e
migranti all’elettroforesi più lentamente delle LDL. Le Lp(a)
sono presenti in quantità estremamente variabili in tutti gli
individui (vedi Par. 3.2i), mentre le
lipoproteine-X si riscontrano in pazienti affetti da processi
ostruttivi delle vie biliari e sembrano derivare da un reflusso
dei lipidi biliari nel sangue.
. Altre lipoproteine minori
sono le Lp(a) (sinking pre-ß lipoproteins), con densità
maggiore delle VLDL ma migranti assieme a queste
all’elettroforesi, e le lipoproteine-X, formate principalmente da
lecitina (67%), colesterolo (23%), albumina e apo C (6%) e
migranti all’elettroforesi più lentamente delle LDL. Le Lp(a)
sono presenti in quantità estremamente variabili in tutti gli
individui (vedi Par. 3.2i), mentre le
lipoproteine-X si riscontrano in pazienti affetti da processi
ostruttivi delle vie biliari e sembrano derivare da un reflusso
dei lipidi biliari nel sangue.
Alcune frazioni lipoproteiche descritte precedentemente sono
identificate anche mediante l’uso di lettere greche in base
alla loro mobilità elettroforetica ed in analogia a quanto è in
uso per le proteine plasmatiche (vedi
Par. 8.7.2): le HDL vengono così chiamate
α-lipoproteine, le LDL β-lipoproteine e le VLDL pre-β-lipoproteine
![]() .
.
I trigliceridi e il colesterolo della dieta sono assorbiti in forma di acidi grassi, monoacil gliceroli e colesterolo libero. Dopo riesterificazione a livello delle cellule della mucosa intestinale, i trigliceridi (composti da acidi grassi di lunghezza da C14 in su) e il colesterolo esterificato sono inseriti nei chilomicroni assieme ai fosfolipidi ed alle apolipoproteine (apo B-48, apo A-I, apoA-II e apo A-IV) sintetizzate dalla mucosa stessa. Appena secreti i chilomicroni (chilomicroni nascenti) passano nella linfa che drena dall’intestino e quindi nel circolo sanguigno generale attraverso il dotto toracico. Nel sangue i chilomicroni vanno incontro ad un riarrangiamento, assumendo apo C-II, apo C-III, apo E, fosfolipidi e colesterolo dalle HDL. L’acquisizione dell’apo C-II permette ai chilomicroni di interagire con la lipoproteina lipasi (LPL) presente sull’endotelio dei capillari del tessuto adiposo, del muscolo scheletrico e del muscolo cardiaco. L’enzima agisce in sede extracellulare idrolizzando i trigliceridi contenuti nei chilomicroni e liberando gli acidi grassi, che sono a loro volta utilizzati dai tessuti a scopo energetico o riesterificati e conservati come tali. Con il procedere dell’idrolisi, il nucleo dei chilomicroni si riduce di volume ed i componenti in eccesso sulla superficie (fosfolipidi, colesterolo libero, apo C-II e apo C-III) sono trasferiti nuovamente sulle HDL. In seguito alla perdita di apo C-II, le micelle (remnants), caratterizzate da un relativamente elevato contenuto in colesterolo esterificato e dalla presenza di apo E ed apo B-48, perdono la capacità di interagire con la LPL e vengono catturate dal fegato con un meccanismo mediato da un recettore che riconosce l’apo E.
Il fegato, a sua volta, produce le VLDL utilizzando trigliceridi, fosfolipidi e colesterolo sintetizzati ex novo o estratti dal sangue circolante. Le VLDL, che contengono apo B-100, apo C-I, apo C-II, apo C-III e apo E, subiscono un processo progressivo di lipolisi mediata dalla LPL ed una perdita delle componenti di superficie a favore delle HDL, così come avviene per i chilomicroni. Le micelle (IDL), che risultano da questo processo, possono o essere catturate dal fegato con un meccanismo mediato da un recettore che riconosce l’apo E o andare incontro ad una ulteriore idrolisi ad opera della lipasi epatica che le converte in LDL. Queste ultime, che contengono più del 70% del colesterolo plasmatico, hanno sulla superficie praticamente la sola apo B-100.
Il recettore per le LDL è una glicoproteina, che può essere espressa sulla superficie di quasi tutti i tipi di cellule. Il recettore è in grado di legarsi sia all’apo B-100 che all’apo E ed è perciò indicato come recettore B-100/E. Il legame delle LDL alle cellule è mediato dall’apo B-100, mentre quello delle IDL e delle HDL è mediato dall’apo E. Malgrado sia presente anche sulle VLDL e le IDL, l’apo B-100 non sembra invece essere in posizione accessibile su queste micelle. Il complesso lipoproteina-recettore penetra per endocitosi nella cellula, dove il recettore è riciclato, mentre la lipoproteina va incontro a degradazione lisosomiale con produzione di colesterolo esterificato e aminoacidi. La sintesi del recettore per le LDL è controllata da un meccanismo di inibizione retrograda in modo da consentire la captazione di una quantità di LDL sufficiente a fornire il colesterolo che serve per la crescita della cellula e per bilanciarne il consumo. Le LDL modificate (mediante ossidazione, glicazione o combinazione con malondialdeide) vengono fagocitate dai macrofagi attraverso un meccanismo dipendente da un recettore diverso dal recettore B-100/E. Questo "recettore spazzino" (scavenger) non viene inibito da un eccesso di colesterolo intracellulare, cosicché l’interiorizzazione delle LDL modificate prosegue, dando luogo a un accumulo di colesterolo in forma di goccioline che conferiscono alle cellule un aspetto schiumoso.
Le HDL sono prodotte nel fegato e nell’intestino tenue. Allo stato nascente sono costituite da apo A-I ed apo A-II ed hanno una forma discoidale, che va incontro ad una rapida trasformazione verso una forma sferica per interiorizzazione del colesterolo dalla superficie verso il nucleo a seguito della sua esterificazione ad opera della lecitina-colesterolo aciltransferasi. Ciò comporta un aumento dell’affinità della superficie delle HDL per il colesterolo libero, che la lipoproteina acquisisce interagendo con le membrane cellulari. L’ingrandimento del nucleo consente inoltre l’inserimento in superficie di altre apolipoproteine (apo C-II, apo C-III e apo E) e di fosfolipidi provenienti dai chilomicroni e dalle VLDL e la conseguente trasformazione delle micelle da una forma a maggiore densità (HDL3) ad una a minore densità (HDL2). A loro volta le HDL2 fungono da donatori di colesterolo esterificato verso i chilomicroni e le LDL. Il trasferimento avviene per mezzo un vettore specifico (cholesteryl ester transfer protein) e permette di veicolare gli esteri del colesterolo verso il fegato dove vengono rimossi. Le HDL2 possono inoltre interagire con il recettore B-100/E delle cellule epatiche ed essere così eliminate.
3.1. LIPOPROTEINE
La classificazione proposta originariamente da Fredrickson suddivide le dislipidemie in cinque tipi in base a quale è la classe lipoproteica contenente l’apo B che risulta aumentata alla elettroforesi. Il tipo I è caratterizzato da un aumento dei chilomicroni, il tipo II da un aumento delle LDL, il tipo III da un aumento delle IDL, il tipo IV da un aumento delle VLDL e il tipo V da un aumento contemporaneo dei chilomicroni e delle VLDL. Come mostrato in Tab. 3.II, l’attuale classificazione, che è stata adottata dall’Organizzazione Mondiale di Sanità, suddivide ulteriormente la dislipidemia tipo II di Fredrickson in due sottotipi (IIa e IIb) a seconda che l’aumento delle LDL sia isolato o accompagnato da un simultaneo incremento delle VLDL.
Tab. 3.II. Classificazione delle iperlipidemie secondo l’Organizzazione Mondiale di Sanità.
| Tipo | Analita principale aumentato |
Analita
minore aumentato |
Banda elettroforetica aumentata |
Lipoproteine aumentate |
|
| I | Trigliceridi | Colesterolo | Banda all’origine | Chilomicroni | |
| IIa | Colesterolo | Banda β | LDL | ||
| IIb | Colesterolo Trigliceridi |
Banda β Banda pre-β |
LDL VLDL |
||
| III | Colesterolo Trigliceridi |
Banda β larga | IDL | ||
| IV | Trigliceridi | Colesterolo |
Banda pre-β | VLDL | |
| V | Trigliceridi | Colesterolo |
Banda all’origine Banda pre-β |
Chilomicroni VLDL |
|
Sebbene sia tuttora in uso, questa classificazione presenta alcuni difetti in quanto descrive le manifestazioni caratteristiche di ogni singolo fenotipo senza però differenziare le forme primarie da quelle secondarie, escludendo inoltre quelle forme dovute a carenza dell’apo B o ad una anomalia delle HDL. Infatti, circa il 10-15% delle dislipidemie osservate non è incasellabile inequivocabilmente in uno dei tipi presi in considerazione nella classificazione di Fredrickson. Questa classificazione delle dislipidemie è perciò attualmente affiancata e in parte soppiantata da una nuova classificazione basata su criteri genetici che mettono in relazione il fenotipo con il meccanismo molecolare all’origine della malattia (Tab. 3.III).
Tab. 3.III. Principali disordini delle lipoproteine
| Lipoproteine contenenti apo B | ||
| Disordini di sintesi e secrezione | ||
| a-β-lipoproteinemia | ||
| malattia da ritenzione di chilomicroni | ||
| ipo-β-lipoproteinemia familiare | ||
| iperlipidemia combinata familiare | ||
| iper-β-lipoproteinemia | ||
| ipertrigliceridemia familiare | ||
| Apo B anomale | ||
| a-β-lipoproteinemia normotrigliridemica | ||
| ipo-β-lipoproteinemia associata a apo B tronche | ||
| deficit familiare di apo B-100 | ||
| Disordini metabolici | ||
| deficit di lipoproteina lipasi | ||
| deficit di apo C-II | ||
| forma familiare da inibitore della lipoproteina lipasi | ||
| dis-β-lipoproteinemia (dislipidemia tipo III) | ||
| ipercolesterolemia familiare | ||
| Lipoproteine HDL | ||
| HDL-colesterolo aumentato | ||
| deficit di cholesteryl ester transfer protein | ||
| deficit di lipasi epatica | ||
| HDL-colesterolo diminuito | ||
| ipo-α-lipoproteinemia familiare | ||
| deficit di apo A-I | ||
| varianti di apo A-I | ||
| morbo di Tangier | ||
| deficit familiare di lecitina-colesterolo aciltransferasi | ||
| malattia a occhio di pesce | ||
3.1.1. Metodi di determinazione
Circa l’80% delle iperlipemie sono classificabili secondo quanto proposto da Fredrickson in modo accurato e con poca spesa, interpretando correttamente il livello di colesterolo e di trigliceridi ematici o esaminando semplicemente l’aspetto del campione di siero o di plasma dopo averlo lasciato una notte in frigorifero. Se il campione appare chiarificato con uno strato cremoso in superficie, è indice che sono presenti dei chilomicroni e la dislipidemia è probabilmente di tipo I o V o, più raramente, di tipo III. Se il campione si mantiene opalescente, è indice che sono presenti delle VLDL e la dislipidemia è probabilmente di tipo IIb, IV o V. Se si verificano entrambe le condizioni (presenza di uno strato cremoso in superficie ed opalescenza del campione), siamo verosimilmente in presenza di una dislipidemia tipo V.
In circa il 20% dei casi l’interpretazione dei dati appare più ardua ed è perciò utile procedere ad una elettroforesi delle lipoproteine e/o alla determinazione dell’HDL-colesterolo e dell’LDL-colesterolo (vedi Par. 3.4). Un esempio dell’utilità di queste metodiche è dato dalla possibilità di poter dimostrare la presenza di una quantità elevata di HDL-colesterolo (800-900 mg/L) in un soggetto con una colesterolemia di 2500-2750 mg/L. Infatti, malgrado sia presente una ipercolesterolemia, in questo caso il colesterolo è distribuito principalmente nelle HDL e quindi il rischio di malattia coronarica non è elevato, come sarebbe potuto apparire ad una analisi più superficiale. Una elettroforesi è inoltre un metodo semplice per evidenziare la presenza di β-lipoproteine a banda larga e permettere la diagnosi di dislipidemia tipo III, quando questa è sospettata per un aumento contemporaneo di colesterolo e trigliceridi.
Le procedure in uso per l’elettroforesi delle lipoproteine prevedono l’utilizzo di un supporto solido (agarosio, acetato di cellulosa, agar, poliacrilamide, amido, carta) su cui far migrare il campione e di opportuni coloranti per i lipidi (Sudan black-B, oil red O, fat red 7B). La diafanizzazione del supporto solido e l’uso di un fotometro a scansione permettono una stima semiquantitativa della concentrazione relativa delle singole bande lipoproteiche
L’elettroforesi su gel di agarosio a pH alcalino (Tris-barbital, pH 8,8) è quella di più comune impiego. Con questa procedura le HDL (α-lipoproteine) migrano più rapidamente verso l’anodo, seguite in ordine dalle VLDL (pre-β-lipoproteine) e dalle LDL (β-lipoproteine). I chilomicroni rimangono fermi nel punto di deposizione del campione. Quadri elettroforetici inusuali possono comparire quando sono presenti elevate concentrazioni di acidi grassi non esterificati (ad esempio, per l’effetto dell’epinefrina su un soggetto sotto stress). In tal caso il complesso acidi grassi-albumina apparirà come una ulteriore banda in posizione anodica rispetto le α-lipoproteine. Se invece la concentrazione di acidi grassi è molto elevata (ad esempio, quando un soggetto ha ricevuto una somministrazione endovenosa di eparina), questi, dopo aver saturato l’albumina, si legano alle lipoproteine e determinano un brusco aumento della mobilità elettroforetica di tutte le frazioni. Un elevato apporto alimentare in un soggetto con danno renale può infine determinare la comparsa di una ulteriore banda elettroforetica (post-α-lipoproteina o HDL1) tra le α-lipoproteine e le pre-β-lipoproteine. Artefatti possono insorgere quando il campione è stato conservato a lungo (diverse settimane in frigorifero o diversi giorni a temperatura ambiente) o è stato sottoposto a ripetuti congelamenti. La conseguente degradazione delle lipoproteine determina in questi casi la comparsa di una banda nel punto di deposizione del campione che può essere scambiata per chilomicroni. Altri artefatti possono insorgere nel corso della procedura di eliminazione dal gel dell’eccesso di colorante (destaining) che può portare ad una decolorazione eccessiva e/o selettiva per alcune frazioni lipoproteiche.
L’elettroforesi su acetato di cellulosa è stata a lungo usata prima dell’introduzione del gel di agarosio. I principali svantaggi erano una sovrastima delle pre-β-lipoproteine e una certa difficoltà nella rimozione del colorante in eccesso e nella conservazione delle lastrine dopo l’elettroforesi. L’elettroforesi su gel di agar è consigliata quando si vogliono evidenziare le lipoproteine-X in un paziente affetto da colestasi, perché queste proteine migrano in agar a pH alcalino verso il catodo e sono quindi separabili dalle altre frazioni. L’elettroforesi su polacrilamide e l’elettroforesi su amido (starch gel) permettono una ottima risoluzione delle bande, ma sono poco usate per il tempo richiesto per la preparazione del gel. L’elettroforesi su carta è ancora considerata il metodo classico per lo studio delle lipoproteine, ma è attualmente in disuso.
3.1.2. Preparazione del campione ed intervalli di riferimento
Per una accurata determinazione dei lipidi e delle lipoproteine in condizioni standardizzate è necessario che il paziente sia a digiuno da almeno 12 ore prima del prelievo, abbia seguito senza variazioni la sua dieta abituale da almeno 3 settimane, non abbia subito recenti variazioni nel peso e non accusi malattie, traumi o postumi di interventi chirurgici. Se il paziente ha subito un infarto nei tre mesi precedenti o sta assumendo farmaci che possono variare l’assetto lipidico (tiroxina, corticosteroidi, estrogeni, androgeni, farmaci antiipertensivi o che abbassano la lipemia) l’analisi deve essere differita. I valori di riferimento per ciascuna classe lipoproteica sono riportati in Tab. 3.IV.
Tab. 3.IV. Distribuzione percentuale delle lipoproteine nel siero. I valori sono riferiti a soggetti normali a digiuno.
Classe lipoproteica (xm + s) |
||||
| Classe d’età (anni) | Sesso |
Beta |
Pre-beta |
Alpha |
4-14 |
M + F |
55 + 5 |
12 + 3 |
33 + 3 |
18-65 |
M |
65 + 8 |
12 + 4 |
23 + 4 |
18-65 |
F |
60 + 6 |
8 + 4 |
32 + 5 |
Quando viene seguita la classificazione di Fredrickson, la valutazione del quadro dislipidemico deve basarsi sull’osservazione qualitativa del campione e sull’analisi comparativa del tracciato elettroforetico delle lipoproteine e dei livelli dei trigliceridi e del colesterolo.
La dislipidemia tipo I (iperchilomicronemia) è molto rara
![]() . In questo caso, il siero
è all’inizio opalescente per aumento dei trigliceridi. Se
conservato per una notte in frigorifero, il siero tuttavia si
chiarifica in quanto i chilomicroni si separano flottando in
superficie. All’elettroforesi questa dislipidemia è
caratterizzata dalla presenza di una frazione lipidica ferma all’origine.
Prima di fare la diagnosi, è molto importante essere sicuri che
il paziente abbia effettivamente osservato il digiuno prescritto,
perché l’iperchilomicronemia potrebbe essere facilmente
indotta da un pasto. Bisogna ricordare inoltre che una
disglobulinemia (svelabile mediante una elettroforesi delle
proteine del siero su gel d’agarosio; vedi
Par. 8.7.1a) e un
conseguente legame di una grossa quantità di lipidi alle IgM
potrebbero dare un quadro elettroforeticamente simile alla
dislipidemia tipo I ed indurre ad errore. Numerosi farmaci
possono infine portare ad una delipidazione delle lipoproteine e
far pensare erroneamente ad una condizione di iperchilomicronemia.
. In questo caso, il siero
è all’inizio opalescente per aumento dei trigliceridi. Se
conservato per una notte in frigorifero, il siero tuttavia si
chiarifica in quanto i chilomicroni si separano flottando in
superficie. All’elettroforesi questa dislipidemia è
caratterizzata dalla presenza di una frazione lipidica ferma all’origine.
Prima di fare la diagnosi, è molto importante essere sicuri che
il paziente abbia effettivamente osservato il digiuno prescritto,
perché l’iperchilomicronemia potrebbe essere facilmente
indotta da un pasto. Bisogna ricordare inoltre che una
disglobulinemia (svelabile mediante una elettroforesi delle
proteine del siero su gel d’agarosio; vedi
Par. 8.7.1a) e un
conseguente legame di una grossa quantità di lipidi alle IgM
potrebbero dare un quadro elettroforeticamente simile alla
dislipidemia tipo I ed indurre ad errore. Numerosi farmaci
possono infine portare ad una delipidazione delle lipoproteine e
far pensare erroneamente ad una condizione di iperchilomicronemia.
La dislipidemia tipo IIa (ipercolesterolemia) è un disordine relativamente frequente ed è caratterizzata da alte concentrazioni di β-lipoproteine con normali livelli di pre-β-lipoproteine. Le α-lipoproteine sono normali o lievemente ridotte, mentre l’LDL-colesterolo è di norma aumentato oltre il 75° percentile (vedi Par. 3.4).
La dislipidemia tipo IIb (ipercolesterolemia con elevati livelli di trigliceridi) è anch’essa una forma comune di dislipidemia. In questo caso vi è un aumento sia delle β-lipoproteine che delle pre-β-lipoproteine. I chilomicroni sono assenti, mentre le α-lipoproteine sono normali o lievemente ridotte.
Nella dislipidemia tipo III (iper-β-lipoproteinemia a banda larga) sono aumentati sia il colesterolo totale che i trigliceridi, in modo tale che il loro rapporto sia circa 1:1. I chilomicroni sono generalmente assenti, mentre le α-lipoproteine sono diminuite. Le β-lipoproteine sono aumentate e formano una banda ampia con mobilità elettroforetica complessiva maggiore del solito. La separazione fra le β-lipoproteine e le pre-β-lipoproteine è meno evidente per l’aumento di una frazione lipoproteica a densità intermedia costituita dalle IDL. La presenza della frazione anomala deve essere confermata all’ultracentrifuga. Alla densità di 1,006 g/mL sarà così possibile separare preliminarmente le LDL e le HDL in fondo alla provetta per svelare in superficie una frazione leggera (identificabile con le IDL anomale) migrante all’elettroforesi in posizione β. Alla densità di 1,21 g/mL sarà infine possibile separate tutte le IDL in superficie ed evidenziare l’alto contenuto in colesterolo di questa frazione.
La dislipidemia tipo IV (ipertrigliceridemia) è discriminabile dal tipo V a patto che il paziente si sia attenuto scrupolosamente al digiuno prescritto. Questa dislipidemia è caratterizzata da un elevato livello di pre-β-lipoproteine. Le β-lipoproteine sono normali o ridotte, le α-lipoproteine sono generalmente ridotte e i chilomicroni sono assenti. Il siero rimane opalescente anche dopo una notte in frigorifero.
Nella dislipidemia tipo V (iperlipemia con chilomicronemia) si osserva un aumento dei chilomicroni, delle β-lipoproteine e delle pre-β-lipoproteine. I trigliceridi sono sempre aumentasi. Il siero conservato per una notte in frigorifero continua ad essere lipemico o fortemente opalescente per la presenza delle pre-β-lipoproteine, mentre i chilomicroni sono evidenziabili per la presenza di una banda flottante in superficie.
3.2. APOLIPOPROTEINE
Le apolipoproteine costituiscono l’elemento strutturale delle lipoproteine, contribuendo alla loro stabilità. Esse inoltre si legano a recettori specifici e modulano gli enzimi che intervengono nel metabolismo lipidico. Le apolipoproteine sono siglate con lettere romane maiuscole. Per quanto riguarda l’apo A e l’apo B il loro nome deriva dal fatto di essere presenti rispettivamente nelle α-lipoproteine (HDL) e nelle β-lipoproteine (LDL). Per le altre sono state utilizzate le successive lettere dell’alfabeto nell’ordine in cui queste apolipoproteine sono state scoperte.
Mentre alcune apolipoproteine sembrano essere costituite da una singola catena polipeptidica, altre invece sono costituite da due o più polipetidi non identici. Inoltre alcune lipoproteine possono presentarsi come isoforme. Per inquadrare tutte queste diverse apoliproteine è stata proposta da Alaupovic una nomenclatura (chiamata nomenclatura ABC) in base alla quale le apolipoproteine sono indicate con lettere maiuscole, i polipeptidi costituenti le stesse con numeri romani e le isoforme con numeri arabi. Così l’apo A comprende l’apo A-I, l’apo A-II e l’apo A-IV, mentre l’apo C è costituito dall’apo C-I, dall’apo C-II e dall’apo C-III. A sua volta, l’apo C-III si presenta come apo C-III-0, apo C-III-1 e apo C-III-2.
3.2a. Apolipoproteina A-I
L’apo A-I costituisce circa il 90% della quota proteica delle HDL2 e il 60-70% delle HDL3. E’ una proteina di 28 kDa sintetizzata dal fegato e dall’intestino con una struttura ad α-elica anfipatica altamente idrofobica da un lato ed idrofilica dall’altro. La sua concentrazione plasmatica è di 1-1,5 g/L e il tempo di permanenza in circolo è di circa 4 giorni. L’apo A-I è un attivatore della lecitina-colesterolo aciltransferasi e partecipa in tal modo al trasporto del colesterolo dalla periferia al fegato. Inibisce inoltre l’aggregazione e l’ossidazione delle LDL, riducendo così la captazione di colesterolo dai macrofagi e la conseguente formazione di lesioni ateromatose.
Una pressoché totale assenza di apo A-I nel plasma si
riscontra in malattie genetiche rare, quali il morbo di Tangier
![]() , il deficit congenito di
apo A-I, il deficit familiare di lecitina-colesterolo
aciltransferasi, la malattia a occhio di pesce (fish eye
disease)
, il deficit congenito di
apo A-I, il deficit familiare di lecitina-colesterolo
aciltransferasi, la malattia a occhio di pesce (fish eye
disease)
![]() . Ridotte
concentrazioni di apo A-I per un suo aumentato catabolismo sono
presenti nell’ipertrigliceridemia familiare
. Ridotte
concentrazioni di apo A-I per un suo aumentato catabolismo sono
presenti nell’ipertrigliceridemia familiare
![]() , nell’iperlipidemia
familiare combinata
, nell’iperlipidemia
familiare combinata
![]() e nell’ipo-α-lipoproteinemia familiare
e nell’ipo-α-lipoproteinemia familiare
![]() e nei soggetti obesi,
sedentari, diabetici, fumatori o trattati con β-bloccanti. Diete ricche di grassi polinsaturi, ma non
monoinsaturi, e gli steroidi anabolizzanti tendono invece a
ridurre la sintesi di apo A-I. Una marcata inibizione della
sintesi si osserva in pazienti con patologie epatiche gravi.
Livelli plasmatici elevati di apo A-I sono presenti nell’iper-α-lipoproteinemia familiare e in altre
alterazioni del metabolismo delle HDL.
e nei soggetti obesi,
sedentari, diabetici, fumatori o trattati con β-bloccanti. Diete ricche di grassi polinsaturi, ma non
monoinsaturi, e gli steroidi anabolizzanti tendono invece a
ridurre la sintesi di apo A-I. Una marcata inibizione della
sintesi si osserva in pazienti con patologie epatiche gravi.
Livelli plasmatici elevati di apo A-I sono presenti nell’iper-α-lipoproteinemia familiare e in altre
alterazioni del metabolismo delle HDL.
Le molteplici azioni dell’apo A-I nel metabolismo lipoproteico rendono conto in gran parte dell’azione protettiva esercitata dalle HDL contro l’insorgenza di malattie dovute all’aterosclerosi. Numerosi studi epidemiologici evidenziano infatti una correlazione inversa tra livelli plasmatici di apo A-I e rischio cardiovascolare. La determinazione dell’apo A-I fornisce pertanto una informazione aggiuntiva nella valutazione dei soggetti con quadro lipidico alterato e con fattori di rischio o storia familiare positiva per l’aterosclerosi precoce.
3.2b. Apolipoproteina A-II
L’apo A-II è una molecola di 17 kDa costituita da due catene polipeptidiche identiche legate da un ponte disolfuro e sintetizzate solo dal fegato. La concentrazione plasmatica è di 300-500 mg/L. La proteina sembra svolgere un ruolo nella regolazione della lipasi epatica e nella modulazione dei processi di interconversione plasmatica delle HDL. Il deficit totale, estremamente raro, non si associa ad alcuna alterazione metabolica né a patologie specifiche.
3.2c. Apolipoproteina A-IV
L’apo A-IV è una proteina di 46 kDa presente nel plasma prevalentemente in forma libera, che aumenta dopo un pasto ricco di grassi ed è perciò probabilmente coinvolta nella sintesi e nella secrezione di lipoproteine ricche di trigliceridi. E’ un attivatore della lecitina-colesterolo aciltransferasi ed è coinvolta nella modulazione del senso di sazietà.
3.2d. Apolipoproteina B
L’apo B è la principale proteina dei chilomicroni e delle VLDL ed è essenzialmente l’unica proteina delle IDL e delle LDL. L’apo B-100, di origine epatica, ha una massa molecolare di 513 kDa. L’apolipoproteina di origine intestinale (apo B-48), che si trova solo nei chilomicroni, ha una massa molecolare che è il 48% di quella dell’apo B-100 e la sua sintesi è il risultato di un processo di editing dell’RNA messaggero, durante il quale la citosina che normalmente si trova nel codone 2153 (CAA) viene sostituita da un uracile. Ciò conduce alla formazione di un codone di arresto (UAA) e alla sintesi di una forma troncata dell’apo B che non viene riconosciuta dal recettore B-100/E. A causa dell’elevata idrofobicità, sia l’apo B-100 che l’apo B-48 non si dissociano mai dalle particelle originarie con il procedere del metabolismo. A causa del rapido catabolismo dei chilomicroni, la concentrazione plasmatica dell’apo B-48 in soggetti normolipidemici a digiuno è molto bassa (pochi mg/L) e pari a circa lo 0,1% di quella dell’apo B-100.
L’apo B-100 è essenziale per l’assemblaggio e la secrezione delle VLDL. Alcune regioni dell’apo B-100 hanno elevata affinità per l’eparina e promuovono il legame delle VLDL con l’endotelio, consentendo l’azione della lipoproteina lipasi. Un altro sito, posto nella regione carbossiterminale forma un legame con l’apolipoproteina(a) permettendo la formazione delle Lp(a) (vedi Par. 3.2i). Nel corso del metabolismo intravascolare delle VLDL, la conformazione delle apo B-100 (così come quelle dell’apo E) si modifica e la proteina acquista la capacità di legarsi al recettore apo B-100/E attraverso la sua porzione carbossiterminale.
Mutazioni che generano un codone d’arresto prematuro nella sequenza nucleotidica relativa alla proteina danno origine alla sintesi di forme troncate, diverse dall’apo B-48, che sono generalmente associate a bassi livelli di LDL-colesterolo e della stessa apo B (ipo-β-lipoproteinemia). Mutazioni clinicamente significative nella regione interessata al legame con il recettore periferico (identificate solo in forma eterozigote) portano ad un ridotto catabolismo delle LDL e sono associate ad ipercolesterolemia.
3.2e. Apolipoproteina C-I
L’apo C-I è una proteina di 7 kDa ed è presente normalmente nel plasma ad una concentrazione di circa 60 mg/L. E’ responsabile dell’attivazione della lecitina-colesterolo aciltransferasi ed ha un ruolo importante nello scambio di colesterolo esterificato tra le lipoproteine e nella rimozione del colesterolo dai tessuti. Come le altre apolipoproteine C, durante il digiuno si trova soprattutto nelle HDL, mentre in fase postprandiale viene ceduta alle lipoproteine neoformate disponendosi sulla loro superficie. Per contro, quando le proteine ricche di trigliceridi (chilomicroni e VLDL) vanno incontro a lipolisi viene nuovamente trasferita sulle HDL.
3.2f. Apolipoproteina C-II
L’apo C-II è una proteina di 8 kDa presente
normalmente nel plasma ad una concentrazione di circa 40 mg/L la
cui funzione principale è quella di attivare la lipoproteina
lipasi. Soggetti con deficit di apo C-II presentano una grave
ipertrigliceridemia con iperchilomicronemia a digiuno
![]() .
.
3.2g. Apolipoproteina C-III
L’apo C-III è una proteina di 9 kDa presente normalmente nel plasma ad una concentrazione di circa 120 mg/L, che costituisce circa il 50% delle apolipoproteine delle VLDL e circa il 2% delle apolipoproteine delle HDL. E’ un attivatore della lecitina-colesterolo aciltransferasi e modula la captazione dei remnants da parte del fegato. Nel plasma sono presenti tre isoforme caratterizzate dalla assenza (apo C-III-0) o dalla presenza di uno (apo C-III-1) o di due (apo C-III-2) molecole di acido sialico legati al residuo della treonina 74. Queste isoforme, la cui funzione è incerta, rappresentano rispettivamente il 14%, il 59% e il 27% della quantità totale di apo C-III.
Sono stati descritti un deficit ereditario combinato di apo A-I
e apo C-III e un deficit combinato di apo A-I, apo C-III e apo A-IV,
entrambi caratterizzati da grave aterosclerosi ad insorgenza
precoce
![]() .
.
3.2h. Apolipoproteina E
L’apo E è una proteina di 34 kDa codificata da
un gene polimorfo caratterizzato dalla presenza di tre possibili
alleli (ε-2, ε-3, ε-4) a trasmissione codominante
in un singolo locus. Le corrispondenti proteine danno luogo a tre
situazioni di omozigosi (E-2/2, E-3/3, E-4/4) e tre possibili
situazioni di eterozigosi (E-2/3, E-2/4, E-3/4) differenziabili
mediante focalizzazione al punto isoelettrico
![]() . Il fenotipo più comune
è E-3/3, presente nel 60% della popolazione.
. Il fenotipo più comune
è E-3/3, presente nel 60% della popolazione.
L’apo E svolge un ruolo fondamentale nel metabolismo
delle lipoproteine in quanto viene riconosciuta da un recettore
epatico specifico per l’apo E e dal recettore apo-100/E. L’affinità
dell’apo E per recettore B-100/E è assai maggiore di quella
dell’apo B-100. Per questo motivo le lipoproteine contenenti
apo E (chilomicroni, remnants, VLDL, IDL, HDL1)
vengono catabolizzate molto più rapidamente delle lipoproteine
contenenti solo l’apo B. L’affinità delle varie
isoforme dell’apo E per il recettore è differente: l’isoforma
E-2 è quella con affinità più bassa ed uno stato di omozigosi
per l’apo E-2 è associato ad un rallentato catabolismo
delle lipoproteine contenenti l’apo E. Il fenotipo E-2/2 è
caratteristico della iperlipoproteinemia di tipo III, cui si
associa un’elevata incidenza di malattie cardiovascolari.
Tuttavia solo una minoranza degli individui con fenotipo E-2/2 è
affetta da questa malattia ![]() .
.
Come l’apo B, l’apo E ha una elevata affinità per l’eparina a cui si lega attraverso il medesimo segmento coinvolto per il legame con il recettore. L’apo E favorisce perciò sia il legame dei chilomicroni e delle VLDL all’endotelio, dove avviene il processo di lipolisi, sia il legame delle lipoproteine aterogene ai mucopolisaccaridi della parete arteriosa. L’apo E svolge inoltre un ruolo essenziale nel trasporto del colesterolo dalla periferia verso il fegato. L’apo E è infatti secreta dai macrofagi nell’ambiente extracellulare dove si associa alle HDL consentendo ad esse di fungere da accettori di colesterolo e di legarsi al recettore per l’apo E e al recettore B-100/E a livello epatico.
E’ stato dimostrato che l’allele E-4 è un fattore
di rischio per l’insorgenza tardiva della malattia di
Alzheimer, nella sua forma sporadica o familiare
![]() .
.
3.2i. Apolipoproteina(a)
L’apo(a) è una glicoproteina ad alto peso
molecolare altamente polimorfa prodotta principalmente dal fegato.
La struttura è omologa a quella del plasminogeno
![]() , sia per la presenza del
dominio proteasico (che tuttavia non può essere convertito nella
forma attiva) che per la presenza di un dominio costituito da
sequenze kringle. Questo ultimo dominio comprende un kringle
omologo al kringle 5 del plasminogeno e diversi altri kringle
simili tra loro e al kringle 4. Il numero di kringle
4 nella sequenza primaria è alla base del polimorfismo dell’apo(a),
nonché della variabilità del suo peso molecolare. La rilevanza
dell’apo(a) nel sistema lipoproteico deriva dal fatto che
essa si associa, mediante la formazione di un ponte disolfuro,
all’apo B-100 a formare una lipoproteina denominata Lp(a). I
livelli plasmatici della Lp(a) sono correlati al peso molecolare
delle isoforme dell’apo(a) e al rapporto tra kringle
4 e kringle 5.
, sia per la presenza del
dominio proteasico (che tuttavia non può essere convertito nella
forma attiva) che per la presenza di un dominio costituito da
sequenze kringle. Questo ultimo dominio comprende un kringle
omologo al kringle 5 del plasminogeno e diversi altri kringle
simili tra loro e al kringle 4. Il numero di kringle
4 nella sequenza primaria è alla base del polimorfismo dell’apo(a),
nonché della variabilità del suo peso molecolare. La rilevanza
dell’apo(a) nel sistema lipoproteico deriva dal fatto che
essa si associa, mediante la formazione di un ponte disolfuro,
all’apo B-100 a formare una lipoproteina denominata Lp(a). I
livelli plasmatici della Lp(a) sono correlati al peso molecolare
delle isoforme dell’apo(a) e al rapporto tra kringle
4 e kringle 5.
La Lp(a) è considerata una lipoproteina aterogena e un fattore di rischio indipendente per l’insorgenza di malattie coronariche. Essa si lega infatti ai glicosaminoglicani con una affinità molto superiore a quella delle LDL. Gran parte dell’aterogenicità sembra dipendere da processi che hanno luogo nell’intima dei vasi arteriosi. L’omologia tra plasminogeno ed apo(a) suggerisce che la Lp(a) possa inibire il legame del plasminogeno alla fibrina e favorire così la trombosi. La mancata attivazione del plasminogeno impedisce, a sua volta, l’attivazione della forma latente del TFG-beta (transforming growth factor-beta) con conseguente stimolazione della proliferazione delle fibre muscolari lisce.
Il ruolo del recettore per le LDL nel catabolismo delle Lp(a) è ancora incerto. Soggetti con ipercolesterolemia familiare, portatori di un gene che codifica per una forma non funzionale del recettore B-100/E, hanno livelli di Lp(a) tre volte superiori rispetto a quelli di soggetti normolipidemici con identico fenotipo. D’altra parte l’aumento dell’attività del recettore B-100/E indotta con mezzi farmacologici (colesterolamina o inibitori della 3-idrossi-3-metil-glutaril-CoA reduttasi) non riduce i livelli di Lp(a).
3.2.1. Metodi di determinazione
Tutti i metodi disponibili per il dosaggio delle
apolipoproteine sono immunologici, cioè si basano su una
reazione antigene-anticorpo. Essi includono metodi di
immunoprecipitazione in un mezzo solido (immunodiffusione
radiale, elettroimmunodiffusione), in un mezzo liquido (nefelometria,
turbidimetria) e metodi che utilizzano traccianti (immunoenzimatici, immunofluorimetrici
o radioisotopici
![]() ).
).
L’anticorpo ideale per il dosaggio di una data apolipoproteina dovrebbe essere diretto contro epitopi presenti sulla superficie delle lipoproteine e dovrebbe essere in grado di reagire con tutte le diverse classi lipoproteiche che contengono la proteina in oggetto. Nei saggi immunologici è possibile utilizzare antisieri policlonali o monoclonali. I primi sono estremamente eterogenei per avidità e specificità di legame. I secondi presentano diversi vantaggi, quali una notevole uniformità chimica, la possibilità di essere prodotti in grandi quantità e un elevato grado di specificità. Tra gli svantaggi va segnalata la possibile sovra- o sottostima di una specifica variante apolipoproteica, dovuta al marcato polimorfismo genetico di queste proteine, o al mascheramento di alcuni siti antigenici da parte della componente lipidica. Questo inconveniente può essere in parte superato con l’impiego di miscele oligoclonali ben caratterizzate e costituite da due o più anticorpi monoclonali.
Per ottenere apo(a) purificata occorre scindere il legame disolfuro con l’apo B-100 in ambiente riducente. Gli agenti riducenti, tuttavia, alterano l’immunoreattività dell’apo(a), probabilmente in seguito alla scissione di ponti disolfuro intramolecolari. Di conseguenza per generare anticorpi contro l’apo(a) si utilizza in genere la Lp(a) integra. Se gli anticorpi ottenuti sono policlonali bisogna pertanto eliminare mediante immunoassorbimento le immunoglobuline che riconoscono l’apo B. Qualunque sia l’anticorpo usato (monoclonale o policlonale), bisogna inoltre avere l’accortezza di verificare la reattività crociata con il plasminogeno a causa dell’omologia dell’apo(a) con questa proteina.
Uno dei principali problemi legati al dosaggio dell’apo(a) e della Lp(a) deriva dell’eterogeneità delle dimensioni dell’apolipoproteina attribuibile al numero variabile di copie del kringle 4. Per esempio, se l’anticorpo utilizzato riconosce un epitopo del kringle 4, la concentrazione di apo(a) misurata dipenderà dal numero di copie della sequenza riconosciuta, sottostimando le isoforme a basso peso molecolare e sovrastimando quelle ad alto peso molecolare. Questo inconveniente può essere risolto selezionando anticorpi (monoclonali) che riconoscano epitopi esterni al kringle 4. Un altro problema è conseguente al cambiamento di immunoreattività dell’antigene a seguito della rimozione di residui glucidici.
Un approccio alternativo alla soluzione di questi problemi
prevede l’utilizzo di un dosaggio ELISA
![]() a sandwich, nel
quale la Lp(a) viene catturata mediante un anticorpo monoclonale
o policlonale contro l’apo(a) e la rivelazione viene fatta
con un anticorpo che riconosce l’apo B-100. Con questo
metodo, tuttavia, non è possibile determinare la quota di apo(a)
libera, che rappresenta circa il 5% del totale, e inoltre si
rischia di sovrastimare i livelli di Lp(a) se sono presenti
numerosi complessi Lp(a)-LDL.
a sandwich, nel
quale la Lp(a) viene catturata mediante un anticorpo monoclonale
o policlonale contro l’apo(a) e la rivelazione viene fatta
con un anticorpo che riconosce l’apo B-100. Con questo
metodo, tuttavia, non è possibile determinare la quota di apo(a)
libera, che rappresenta circa il 5% del totale, e inoltre si
rischia di sovrastimare i livelli di Lp(a) se sono presenti
numerosi complessi Lp(a)-LDL.
3.2.2. Preparazione del campione ed intervalli di riferimento
Il campione può essere costituito da siero o plasma. L’uso dell’EDTA come anticoagulante presenta il vantaggio di esercitare una azione protettiva nei confronti della degradazione enzimatica delle lipoproteine. L’uso del plasma per i campioni che devono essere conservati congelati non è consigliabile in quanto la formazione di coaguli di fibrina durante lo scongelamento potrebbe compromettere una misurazione accurata dei volumi del campione.
Nei soggetti con patologie cardiovascolari precoci, familiarità positiva per malattie cardiovascolari, elevati livelli di LDL-colesterolo e bassi livelli di HDL-colesterolo (vedi Par. 3.4) è consigliabile determinare il livello ematico dell’apo A-I, dell’apo B-100 e della Lp(a). Dagli studi disponibili in letteratura emerge l’evidenza che bassi livelli di apo A-I (< 1 g/L) e/o elevati livelli di apo B-100 (> 1 g/L) sono discriminanti per l’individuazione di specifiche popolazioni ad alto rischio cardiovascolare. Livelli elevati di Lp(a) (> 0,3 g/L) contribuiscono ad aumentare in modo significativo tale rischio.
3.3. COLESTEROLO
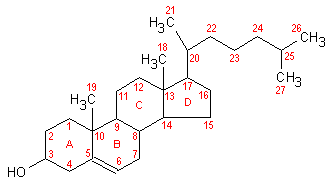
Fig. 3.1. Colesterolo. La molecola comprende tre anelli cicloesanici (A, B, C) fusi tra loro ed un anello terminale ciclopentanico (D). In rosso è riportata la numerazione convenzionale degli atomi di carbonio.
Aumentati livelli di colesterolo o, più specificatamente,
aumentati livelli di LDL-colesterolo (vedi Par. 3.4)
sono in rapporto con un aumentato rischio di cardiopatia coronarica. Il rischio aumenta progressivamente con l’aumentare
dei livelli di colesterolo, particolarmente quando questi
superano i 2 g/L. Esistono inoltre prove sostanziali che la
riduzione dei livelli di colesterolo totale e di LDL-colesterolo
porta ad una diminuita incidenza di cardiopatia coronarica
![]() .
.
3.3.1. Metodi di determinazione
I numerosi metodi proposti per la determinazione della colesterolemia, molti dei quali tuttora in uso, rappresentano ancora oggi dei tentativi non del tutto soddisfacenti per venire incontro all’esigenza di economicità, semplicità e rapidità nell’esecuzione e di maggiore accuratezza e precisione nei risultati. Essi si basano su reazioni colorimetriche non enzimatiche (reazione di Liebermann-Burchard, reazione al FeCl3-H2SO4, reazione all’acido p-toluensulfonico) o sull’uso della reazione enzimatica catalizzata dalla colesterolo ossidasi.
3.3.1a. Reazioni colorimetriche
La reazione di Liebermann-Burchard avviene in un mezzo reso fortemente acido in presenza di acido solforico, acido acetico e anidride acetica e consiste nella graduale ossidazione del colesterolo fino a formare un cromoforo dell’acido colesta-esaene-sulfonico. Malgrado sia la metodica non enzimatica più frequentemente usata, la reazione di Liebermann-Burchard risente di numerose variabili quali la concentrazione dei reagenti, la quantità d’acqua presente nella miscela finale, la temperatura e il tempo di reazione e la lunghezza d’onda della luce utilizzata per la misura del prodotto finale. Il colore che si sviluppa nella reazione è instabile nel tempo ed è più intenso quando il colesterolo è esterificato rispetto a quando è libero. Infine alcune sostanze presenti nel campione biologico (bilirubina, retinolo) o aggiunte nella miscela di reazione (digitonina - utilizzata per precipitare il colesterolo non esterificato) possono interferire nel dosaggio dando luogo ad una sovrastima dell’analita.
La reazione al FeCl3-H2SO4 dà luogo ad un colore più intenso e costante nel tempo rispetto a quanto osservato con la reazione di Liebermann-Burchard per l’effetto stabilizzante del metallo sulla formazione del catione enilico ad alte concentrazioni di acido solforico, cosa che rende questa procedura particolarmente adatta per lo sviluppo di micrometodi. Inoltre, quando l’acido solforico è aggiunto nella miscela di reazione separatamente dagli altri reagenti (ma non quando viene premescolato a questi), il colesterolo libero e quello esterificato sviluppano un colore di medesima intensità, rendendo superflua una preventiva saponificazione dell’analita. L’azide sodica (a volte usata per inibire la crescita batterica), gli alogeni, i perossidi e certi farmaci e vitamine possono interferire con la reazione al FeCl3-H2SO4. E’ inoltre preferibile deproteinizzare il campione prima di far sviluppare il colore. Ciò può essere fatto indifferentemente per aggiunta di un solvente organico o per precipitazione in acido. Questo secondo metodo è apparentemente più semplice, ma può determinare una rimozione del ferro con le proteine, causando così un insufficiente sviluppo del colore, o rendere più difficoltosa una eventuale, successiva rimozione della bilirubina dall’estratto.
La reazione all’acido p-toluensulfonico ha i seguenti vantaggi rispetto alla reazione di Liebermann-Burchard: i reagenti sono più stabili, il colore del prodotto di reazione non si modifica nel tempo, il colore sviluppato dal colesterolo libero e quello sviluppato dal colesterolo esterificato hanno la medesima intensità. Tuttavia in questo caso la bilirubina interferisce notevolmente nella determinazione del colesterolo dando luogo spesso ad una sovrastima dell’analita.
3.3.1b. Metodo enzimatico
La determinazione enzimatica del colesterolo prevede l’idrolisi del colesterolo esterificato, l’ossidazione del colesterolo libero a colest-4-en-3-one a spese dell’ossigeno atmosferico con produzione di perossido di idrogeno e il dosaggio di quest’ultimo composto mediante reazioni enzimatiche e/o colorimetriche. Questo metodo presenta il vantaggio di un’elevata specificità per cui la reazione può essere seguita direttamente nel siero. Il principale problema risiede nel fatto che l’idrolisi degli esteri del colesterolo è spesso solo parziale e che quindi la concentrazione del colesterolo totale può essere sottostimata. Si è visto inoltre che il grado di idrolisi raggiungibile nel corso della reazione enzimatica dipende sia dalla natura dell’acido organico esterificante (gli esteri dell’acido arachidonico e dell’acido acetico sono particolarmente resistenti all’azione delle esterasi) sia dal tipo di enzima usato (le esterasi di origine microbica hanno maggiore difficoltà, rispetto alle esterasi di origine animale, ad idrolizzare gli esteri del colesterolo con acidi grassi polinsaturi a catena lunga). Ciò pone seri problemi all’affidabilità del metodo.

3.3.2. Preparazione del campione ed intervalli di riferimento
Il paziente deve essere a digiuno e devono essere rispettate tutte le condizioni riportate nel Par. 3.1.2. La concentrazione plasmatica di colesterolo risente dei cambiamenti di volume ematico quando il paziente si mette supino o quando viene posto un laccio sull’arto. Infatti il colesterolo diminuisce del 10-15% se il paziente è disteso, ma aumenta circa di eguale misura se il vaso è stretto dal laccio per più di 5 minuti. Anche gli anticoagulanti (ossalato, EDTA) causano una diminuzione del 2-3% del livello plasmatico di colesterolo richiamando acqua dai globuli rossi. Il fluoruro di sodio, aggiunto a volte nel campione che deve essere usato per la determinazione della glicemia, determina una sottostima della concentrazione del colesterolo sia con i metodi colorimetrici che con quelli enzimatici.
La American Heart Association raccomanda come valori massimi per la colesterolemia 2,2 g/L nell’adulto e 2 g/L nel bambino. Valori ancora più bassi sono stati proposti nel 1984 dalla Consensus Conference di Bethesda. Questi limiti sono inferiori persino rispetto al valore medio che, nella popolazione americana fra i 40 e i 60 anni, è di 2.25 g/L. E’ stato però visto che, per la colesterolemia, l’avere dei valori nell’ambito della "normalità" non garantisce dal rischio di malattia cardiovascolare. Così soggetti che hanno una colesterolemia maggiore di 3,1 g/L, pur essendo all’interno del 95° percentile nell’ambito d’età fra i 51 e i 59 anni, hanno un rischio del 50% di andare incontro ad infarto, mentre popolazioni praticamente esenti da malattia aterosclerotica nello stesso ambito d’età hanno valori medi di colesterolemia di 1,5 g/L.
3.4. HDL-COLESTEROLO E LDL-COLESTEROLO
Una volta identificata in un soggetto la necessità di eseguire l’analisi delle lipoproteine, l’interesse si sposta dal colesterolo totale all’LDL-colesterolo. Il fine ultimo della identificazione occasionale e dello screening è quello di individuare i soggetti con elevati livelli di LDL-colesterolo e l’obiettivo specifico del trattamento è la riduzione di tale livello. Ne consegue che l’LDL-colesterolo servirà come indice-chiave per le decisioni cliniche da prendere in merito al trattamento ipocolesterolemizzante. Il dato riguardante l’HDL-colesterolo è utile soprattutto nei soggetti che presentano una trigliceridemia normale e una colesterolemia al limite dei valori di riferimento, dove il riscontro di un HDL-colesterolo anormalmente elevato o basso può costituire un criterio importante per decidere il trattamento più appropriato da intraprendere.
3.4.1. Metodi di determinazione
I metodi più frequentemente usati nella determinazione del HDL-colesterolo si basano sulla precipitazione selettiva delle VLDL e delle LDL e sul dosaggio del colesterolo sul supernatante così ottenuto. Gli agenti precipitanti maggiormente usati sono l’eparina-cloruro di manganese, il destrano solfato-cloruro di calcio o magnesio e il fosfotungstato di sodio.
Il metodo basato sull’uso dell’eparina-cloruro di manganese non è compatibile (per la presenza di ioni Mn+2) con gran parte dei metodi enzimatici utilizzati per la determinazione del colesterolo mentre può essere accoppiato alla reazione di Liebermann-Buchard. Le VLDL e le LDL precipitano solo parzialmente in campioni con un contenuto di trigliceridi superiore a 4 g/L.
La precipitazione delle lipoproteine con destrano solfato e sali di calcio o magnesio permette un successivo dosaggio del colesterolo mediante il metodo enzimatico. Tuttavia molte delle procedure utilizzanti il destrano (specie se a peso molecolare inferiore a 50.000) tendono a sottostimare l’HDL-colesterolo.
Anche il metodo utilizzante il fosfotungstato di sodio sottostima l’HDL-colesterolo, ma in misura minore rispetto al metodo utilizzante il destrano. Esso è particolarmente utile per precipitare le VLDL e le LDL in sieri ipertrigliceridemici. Il suo principale svantaggio è di essere molto sensibile a variazioni di temperatura o di concentrazione dei reagenti.
L’LDL-colesterolo è ricavato indirettamente utilizzando i dati (espressi in mg/L) del colesterolo totale, dell’HDL-colesterolo e dei trigliceridi mediante la formula:
[LDL-colesterolo] = [colesterolo totale] – [HDL-colesterlo] – [trigliceridi] x 0,2
La formula presuppone che la maggior parte dei trigliceridi si trovi nelle VLDL e che vi sia un rapporto di 5:1 tra trigliceridi e colesterolo nella frazione VLDL. Per questa ragione la formula non è valida nei soggetti con dislipidemia tipo III (vedi Par. 3.1) o con trigliceridemia superiore a 4 g/L.
In alternativa, l’LDL-colesterolo può essere determinato direttamente utilizzando in sequenza due detergenti, in modo da dissolvere, in un primo momento, tutte le lipoproteine diverse dalle LDL (chilomicroni, VLDL, IDL, HDL) e, in un secondo momento, le sole LDL. Il colesterolo, che si libera per aggiunta dei detergenti, viene cimentato in presenza di una esterasi e una ossidasi specifica in modo da produrre perossido di idrogeno (vedi Par. 3.3.1b).
Il perossido di idrogeno, prodotto dal colesterolo liberato per aggiunta del primo detergente, è decomposto mediante una catalasi o fatto reagire con 4-aminoantipirina in presenza di una perossidasi in modo da formare un prodotto di reazione incolore. Il perossido di idrogeno, prodotto dal colesterolo liberatosi dalle LDL dopo l’aggiunta del secondo detergente, è fatto invece reagire con un cromogeno in presenza di perossidasi e il prodotto di reazione è dosato spettrofotometricamente.
3.4.2. Preparazione del campione ed intervalli di riferimento
Sebbene la lipemia postprandiale non determini variazioni nel livello dell’HDL-colesterolo, è buona norma richiedere un campione a digiuno per evitare possibili interferenze nell’analisi. Il plasma e il siero possono essere usati indifferentemente e l’EDTA è l’anticoagulante di scelta. E’ comunque necessario rimuovere i globuli rossi o il coagulo entro due ore dal prelievo per evitare che lecitina-colesterolo aciltransferasi vari il rapporto tra colesterolo libero ed esterificato e la sua distribuzione fra le lipoproteine.
I valori di riferimento per l’HDL-colesterolo e l’LDL-colesterolo
variano con l’età e il sesso. Generalmente le tabelle
riguardanti le due frazioni sono esaminate simultaneamente e
confrontate con le tabelle di rischio coronarico. In generale
livelli di LDL-colesterolo compresi tra 1.3 e 1,6 g/L sono
considerati borderline, mentre quelli superiori a 1,6 g/L
sono classificati ad alto rischio. Bassi livelli di HDL-colesterolo
(inferiori a 350 mg/L) sono da ritenersi un ulteriore fattore di
rischio tale da influenzare le decisioni cliniche riguardo il
trattamento
![]() .
.
3.5. TRIGLICERIDI
Fig. 3.2. Triacilglicerolo
La determinazione dei trigliceridi ematici può essere utile
nelle seguenti circostanze: (1) per stimare la
concentrazione del colesterolo contenuto nelle VLDL, per una
misura indiretta dell’LDL-colesterolo (vedi Par.
3.4.1); (2) per valutare il metabolismo lipidico nel
suo insieme nell’analisi dei fattori di rischio per la
malattia coronarica; (3) per determinare se un basso
livello di HDL-colesterolo sia correlabile ad una
ipertrigliceridemia
![]() (vedi Par. 3.2a); (4)
per valutare il rischio di insorgenza di una pancreatite acuta
attribuibile ad una iperchilomicronemia familiare
(vedi Par. 3.2a); (4)
per valutare il rischio di insorgenza di una pancreatite acuta
attribuibile ad una iperchilomicronemia familiare
![]() (vedi Par.
3.1.2); (5) per vedere se i xantomi eruttivi, i
xantomi palmari e la lipemia retinalis del paziente sono
da attribuirsi effettivamente ad un aumento delle lipoproteine
ricche in trigliceridi; (6) per evidenziare una
ipertrigliceridemia secondaria all’uso di antiipertensivi,
di farmaci che diminuiscono la colesterolemia o hanno altre
funzioni (ad esempio, estrogeni); (7) per seguire l’efficacia
della dieta, dell’esercizio fisico o di farmaci che
diminuiscono la trigliceridemia.
(vedi Par.
3.1.2); (5) per vedere se i xantomi eruttivi, i
xantomi palmari e la lipemia retinalis del paziente sono
da attribuirsi effettivamente ad un aumento delle lipoproteine
ricche in trigliceridi; (6) per evidenziare una
ipertrigliceridemia secondaria all’uso di antiipertensivi,
di farmaci che diminuiscono la colesterolemia o hanno altre
funzioni (ad esempio, estrogeni); (7) per seguire l’efficacia
della dieta, dell’esercizio fisico o di farmaci che
diminuiscono la trigliceridemia.
3.5.1. Metodi di determinazione
Il livello dei trigliceridi può essere misurato mediante la determinazione quantitativa del glicerolo in essi contenuto mediante reazioni colorimetriche o metodi enzimatici. In tutti i casi la misura deve essere corretta per il glicerolo contenuto inizialmente nel campione. Un aumento del glicerolo può essere osservato nelle condizioni di stress, dopo infusione di mannitolo o trattamento di pazienti coronaropatici con nitroglicerina, nel diabete mellito, in alcune epatopatie, nel corso di emodialisi o a seguito dell’uso di siringhe o provette lubrificate con glicerolo.
3.5.1a. Reazioni colorimetriche
La procedura prevede quattro tappe successive: (1) estrazione dei trigliceridi, (2) loro saponificazione, (3) ossidazione del glicerolo a formaldeide, (4) determinazione quantitativa della formaldeide.
L’estrazione viene comunemente fatta in metanolo, etanolo, isopropanolo o cloroformio e serve per denaturare le lipoproteine e liberare così il trigliceride che può essere purificato per partizione in solventi organici (esano, nonano) o con l’uso di adsorbenti (zeolite, silicato di magnesio attivato). La saponificazione del trigliceride avviene generalmente a caldo in presenza di potassa alcolica
![]()
Il glicerolo viene quindi ossidato a formaldeide in presenza di periodato.
![]()
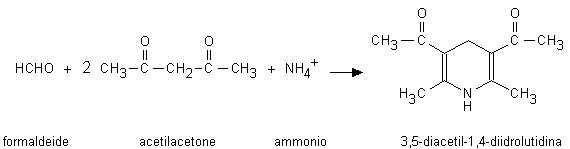
La formaldeide viene infine misurata per mezzo di una reazione colorimetrica (reazione di Eegriwe, di Schryver o di Pay) o al fluorimetro dopo condensazione con acetilacetone e ammoniaca (reazione di Hantzsch; Fig. 3.3).
Fig. 3.3. Reazione di Hantzsch
3.5.1b. Metodi enzimatici
I metodi enzimatici richiedono l’iniziale idrolisi del trigliceride ad opera di una lipasi. Generalmente, alla miscela di reazione viene aggiunto un enzima proteolitico (a -chimotripsina) per disgregare le lipoproteine.

Sono stati descritti diversi metodi per il dosaggio del glicerolo che prevedono l’utilizzo di uno, due o tre reazioni enzimatiche. Infatti il glicerolo può essere ossidato direttamente a diidrossiacetone in presenza di NAD+.
![]()
In alternativa il glicerolo può essere fosforilato a glicerolo-3-fosfato.
![]()
e quest’ultimo composto può essere a sua volta ossidato a diidrossiacetonefosfato a spese dell’NAD+
![]()
o a spese dell’ossigeno atmosferico.
![]()
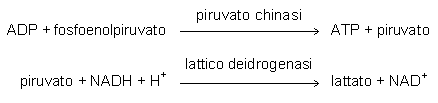
Un ulteriore metodo, infine, prevede di determinare enzimaticamente non il glicerolo-3-fosfato (come nei due casi precedenti), ma l’ADP che si è formato nella reazione catalizzata dalla glicerolo chinasi.
3.5.2. Preparazione del campione ed intervalli di riferimento
Il paziente deve essere a digiuno e devono essere rispettate tutte le condizioni riportate nel Par. 3.1.2. Infatti, se il paziente ha mangiato, non solo non è più possibile interpretare il significato dell’ipertrigliceridemia, ma la presenza di chilomicroni nel campione può interferire sia con il saggio colorimetrico sia nella determinazione dei volume del campione. Il paziente deve inoltre astenersi dal bere alcool per almeno 36 ore prima dell’analisi in quanto questo composto determina una brusca e transiente elevazione della trigliceridemia.
La determinazione può essere fatta sia sul plasma (reso incoagulabile per aggiunta di EDTA) che sul siero. I valori nel plasma sono inferiori del 2-4% rispetto ai valori del siero in quanto gli anticoagulanti (in particolare il fluoruro, il citrato e l’ossalato) determinano una fuoriuscita di acqua dai globuli rossi.
Valori di trigliceridi inferiori a 2,5 g/L sono da
considerarsi normali, anche se soggetti con questi valori possono
presentare ugualmente altre importanti alterazioni delle
lipoproteine e delle apolipoproteine. Livelli di trigliceridi a
digiuno compresi fra 2,5 g/L e 5 g/L si associano ad un aumento
del rischio di malattia cardiovascolare (il doppio rispetto la
norma) e richiedono ulteriori indagini cliniche sul paziente
![]() .
Valori superiori a 5 g/L portano invece ad un aumento del rischio
per la pancreatite acuta.
.
Valori superiori a 5 g/L portano invece ad un aumento del rischio
per la pancreatite acuta.
3.6. CORPI CHETONICI
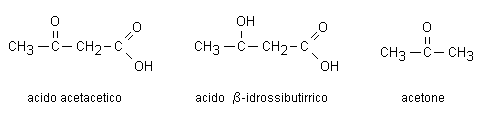
Fig. 3.4. Corpi chetonici
Gli acidi grassi sono catabolizzati ad unità bicarboniose attraverso un processo ossidativo che porta alla formazione di acetil CoA. Al diminuire del rapporto NAD/NADH l’ossidazione degli acidi grassi viene inibita. Contemporaneamente, l’accumulo di acetil CoA porta ad una riduzione della glicolisi anaerobia. Per aumentare il livello di NAD+ e rendere disponibile del CoA libero, vengono perciò messe in atto una serie di reazioni che portano alla formazione dei corpi chetonici (acido acetacetico, acido β-idrossibutirrico ed acetone).
I corpi chetonici aumentano quando vi è una eccessiva mobilitazione di acidi grassi dal tessuto adiposo. Ciò avviene nel diabete, nel digiuno, nell’intossicazione alcolica acuta e in quelle situazioni di stress che portano ad una iperincrezione di ormoni iperglicemizzanti.
3.6.1. Metodi di determinazione
La determinazione dei corpi chetonici è resa difficoltosa dall’estrema variabilità del loro rapporto nel corso della malattia e dal fatto che nessun metodo è capace di misurarne la concentrazione totale. I metodi di dosaggio devono inoltre essere sufficientemente semplici da essere applicati in condizioni di emergenza e sufficientemente rapidi.
L’acido acetacetico può essere evidenziato qualitativamente in presenza dicloruro ferrico con formazione di un composto di colore rosso. L’acetone può essere dosato colorimetricamente in presenza di vanillina con formazione di divanillinacetone.
L’acido acetacetico e l’acetone, ma non l’acido β-idrossibutirrico, reagiscono con il nitroprussiato di sodio formando un prodotto di colore scarlatto. Su questo principio si basano le determinazioni semiquantitative dei corpi chetonici nel plasma o nelle urine mediante cartine reattive.
I metodi enzimatici per il dosaggio dell’acido acetacetico e dell’acido β-idrossibutirrico si basano entrambi sulla reazione catalizzata dalla β-idrossibutirrato deidrogenasi. A pH neutro, la reazione è spostata verso la formazione dell’acido β-idrossibutirrico e NAD+. La reazione può essere spostata in direzione opposta aggiungendo dell’idrazina nella miscela al fine di sottrarre l’acido acetacetico all’equilibrio. L’aggiunta di ossalato può servire per inibire la contemporanea ossidazione dell’acido lattico catalizzata dalla lattico deidrogenasi, quando questi composti sono presenti come inquinanti nella miscela di reazione.

L’acido acetacetico può essere inoltre convertito in acetone o per acidificazione o scaldando il campione, mentre l’acido β-idrossibutirrico può essere ossidato ad acetone in presenza di bicromato. L’acetone può essere a sua volta determinato in gas-cromatografia o mediante procedure radiochimiche dopo averlo fatto reagire con 125I-Cl.
3.6.2. Preparazione del campione ed intervalli di riferimento
Il saggio può essere eseguito su plasma, siero o urine. La presenza di batteri nelle urine può determinare la rapida scomparsa dei corpi chetonici. Inoltre l’acetone è un composto volatile e può essere perso per evaporazione. La concentrazione di acido acetacetico nel plasma è di 5-30 mg/L. Il rapporto fra i diversi corpi chetonici è generalmente di 2% acetone, 20% acido acetacetico e 78% acido β-idrossibutirrico. In condizioni normali, i corpi chetonici non sono rivelabili nelle urine con il metodo al nitroprussiato di sodio.
| aggiornamento: 26/07/11 |