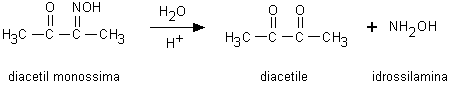|
|
Costantino Salerno |
|
|
Appunti di Biochimica Clinica |
|
|
6. CICLO DELL’UREA
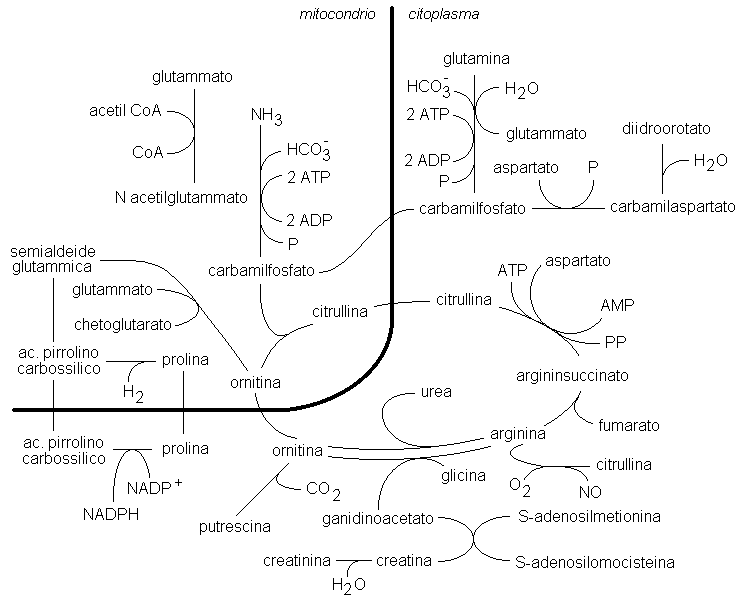
L’urea è sintetizzata nel fegato attraverso l’azione combinata di due enzimi mitocondriali (carbamilfosfato sintetasi I e N-acetilglutammato sintetasi) e di quattro enzimi catalizzanti una sequenza ciclica di reazioni (ornitina transcarbamilasi, nel mitocondrio; argininosuccinato sintetasi, argininosuccinato liasi e arginasi, nel citoplasma). L’urea viene formata a spese di due azoti provenienti rispettivamente dal gruppo α-aminico dell’aspartato e dall’ammoniaca. L’aspartato si forma per transaminazione dall’ossalacetato, la cui concentrazione intracellulare dipende dalla reazione anaplerotica catalizzata dalla piruvato carbossilasi. L’ammoniaca deriva, nel fegato, in gran parte dalle deaminazioni ossidative (catalizzate dalla glutammico deidrogenasi e dalle aminoacido ossidasi) e non ossidative (catalizzate dalle deidratasi specifiche) degli aminoacidi. La principale fonte extraepatica di ammoniaca è l’intestino dove questo catabolita è prodotto dalla glutamina (ad opera della glutaminasi intestinale), dalla urea e dalle proteine alimentari (ad opera di enzimi batterici). Durante l’esercizio fisico, un’altra fonte importante di ammoniaca è il muscolo, dove viene prodotta attraverso la reazione catalizzata dall’adenilato deaminasi (vedi Par. 4.1b).
Il gruppo carbonilico dell’urea deriva dal carbamilfosfato (Fig. 6.1). Questo è sintetizzato nel mitocondrio a partire dall’anidride carbonica e dall’ammoniaca nella reazione catalizzata dalla carbamilfosfato sintetasi I. Il carbamilfosfato è sintetizzato anche nel citoplasma della cellula (ad opera della carbamilfosfato sintetasi II e a spese dell’anidride carbonica e della glutamina), ma in tal caso è essenzialmente utilizzato nella formazione delle pirimidine. Le due frazioni di carbamilfosfato non sono totalmente separate, sebbene la permeabilità mitocondriale per questo composto sia bassa: un blocco del ciclo dell’urea a valle della sintesi del carbamilfosfato determina, infatti, una uscita nel citoplasma del carbamilfosfato inutilizzato e un conseguente aumento della sintesi (e dell’escrezione urinaria) di acido orotico, uracile ed uridina (vedi Par. 4.2.1). A differenza della carbamilfosfato sintetasi II, la carbamilfosfato sintetasi I è attivata dall’N-acetilglutammato. Questo effettore allosterico è sintetizzato nel mitocondrio a partire dall’acetil CoA e dal glutammato ed è idrolizzato in acetato e glutammato nel citoplasma. L’inibizione del ciclo dell’urea negli errori del metabolismo degli acidi organici è probabilmente dovuta ad una inibizione da parte di questi cataboliti (o dei loro tioesteri) dell’N-acetilglutammato sintetasi o della carbamilfosfato sintetasi o ad una deplezione di acetil CoA (vedi Par. 6.1c).
L’ornitina costituisce la base su cui viene costruita la molecola di urea ed è allo stesso tempo substrato iniziale e prodotto finale del ciclo biosintetico. Oltre che nella sintesi della citrullina, l’ornitina è utilizzata nella reazione di transaminazione con il chetoglutarato a formare glutammato e semialdeide glutammica (nel mitocondrio) e, in minor misura, nella reazione di decarbossilazione a putrescina (nel citoplasma). La transaminazione intramitocondriale dell’ornitina costituisce un’importante via metabolica che collega il ciclo dell’urea con il ciclo degli acidi tricarbossilici e con la biosintesi della prolina. L’ornitina è inoltre un precursore indiretto dell’acido γ-aminobutirrico (GABA) sia attraverso sia la decarbossilazione del glutammato che la deaminazione della putrescina.
L’arginina deriva in gran parte dalla dieta. Quando l’apporto
alimentare di arginina è insufficiente, l’ornitina e le
reazioni del ciclo dell’urea sono utilizzate nella sintesi
di questo aminoacido. Una quota dell’arginina è utilizzata
nella reazione catalizzata dalla glicina transaminidasi per la
sintesi del guanidinoacetato. Questo composto è a sua volta N-metilato
a spese della S-adenosilmetionina e trasformato in creatina. La
creatina, sintetizzata principalmente nel fegato e nel pancreas,
viene trasportata negli organi periferici (in gran parte nei
muscoli), dove viene fosforilata e quindi utilizzata per il
fabbisogno energetico cellulare. La creatina e la fosfocreatina
vanno incontro ad una reazione di ciclizzazione non enzimatica
che porta alla formazione di creatinina. L’arginina è
infine substrato nella reazione catalizzata dalla NO sintetasi
che porta alla formazione di ossido nitrico, una molecola di
grande importanza come modulatore metabolico
![]() , e di citrullina.
, e di citrullina.
L’urea costituisce l’80-90% di tutto l’azoto escreto da un soggetto adulto sano che si nutre con una dieta di tipo occidentale. L’urea è filtrata dai glomeruli renali, ma è riassorbita per circa il 40-50% a livello dei tubuli prossimali. In un soggetto normale, la produzione di urea supera l’escrezione renale. La rimanente urea è degradata in ioni ammonio dalla flora batterica intestinale. Il filtrato glomerulare non contiene ammoniaca. Questa è prodotta nei tubuli renali per deaminazione della glutamina in presenza di glutaminasi. L’ammoniaca diffonde nel fluido tubulare, dove reagisce con i protoni secreti formando lo ione ammonio. La creatinina è liberamente filtrata dai glomeruli renali e non è riassorbita dai tubuli. Una piccola quantità di creatinina urinaria deriva da un processo di secrezione tubulare.
L’ammoniaca, l’urea, la creatina e la creatinina sono i principali metaboliti in relazione con il ciclo dell’urea che vengono comunemente dosati in biochimica clinica.
Fig. 6.1. Il ciclo dell’urea
6.1. AMMONIACA
La determinazione dell’ammoniemia è utile quando si sospetta, nell’adulto, una encefalopatia epatica o, nel bambino, una sindrome di Reye o un errore metabolico congenito.
6.1a. Encefalopatia epatica.
Questa sindrome è caratterizzata da disturbi della coscienza, della personalità, e dell’intelligenza, e da alterazioni neurologiche (flapping tremor, iperriflessia, rigidità) ed elettroencefalografiche conseguenti a una grave insufficienza della funzionalità epatica e/o alla formazione di cortocircuiti venosi fra la porta e il circolo sistemico. Causa del danno cerebrale sarebbe l’accumulo di sostanze tossiche (ammoniaca, amine mimanti l’azione di neurotrasmettitori, acidi grassi a catena corta, ed altri composti non ancora completamente identificati) assorbite dall’intestino e non metabolizzate adeguatamente dal fegato. Un rimarchevole aumento dell’ammoniemia è generalmente osservabile nel caso di una severa necrosi epato-cellulare. Anche i pazienti cirrotici e quelli con anastomosi porta-cava presentano spesso un aumento dell’ammoniemia.
Fattori che possono determinare un aumento dell’ammoniaca nel sangue sono (1) un’eccessiva formazione di ammoniaca ad opera di batteri intestinali per deaminazione di aminoacidi derivanti dall’idrolisi di proteine alimentari o di proteine di origine ematica (a causa del sanguinamento intraluminare di varici venose) o per idrolisi dell’urea accumulatasi nell’intestino a seguito di una alterazione della funzionalità renale, (2) una diminuita sintesi di urea da parte del fegato dovuta ad un’alterazione della sua funzionalità o alla presenza di corto-circuiti fra il circolo portale e il circolo sistemico, (3) un’aumentata immissione nel circolo sistemico di ammoniaca prodotta ad opera della glutaminasi renale e non escreta come ione ammonio nelle urine a causa della alcalosi (spesso dovuta ad iperventilazione di origine centrale) e dell’ipocalemia che accompagna l’insufficienza epatica.
L’iperammoniemia è solo grossolanamente correlata all’entità del danno cerebrale. L’aumento della ammoniemia può infatti precedere l’insorgenza del coma così come la sua diminuzione verso valori normali può precedere di 48 - 72 ore il miglioramento della sintomatologia neurologica. Inoltre, in circa il 10% dei pazienti con encefalopatia epatica l’ammoniemia è nei limiti della norma. L’alterazione della funzionalità cerebrale (quando è presente) sarebbe dovuta ad un danno diretto dell’ammoniaca sulle membrane neuronali e al fatto che questo composto favorisce la formazione di acido glutammico e di glutamina, sottraendo così l’acido α-chetoglutarico al ciclo di Krebs da cui dipende gran parte del metabolismo cerebrale. L’alcalosi potrebbe incrementare l’azione tossica dell’ammoniaca favorendo la sua penetrazione (in forma non protonata) attraverso le membrane.
6.1b. Sindrome di Reye
La malattia è, in circa il 90% dei casi, una complicanza di un’infezione virale delle prime vie respiratorie, spesso dovuta al virus influenzale B, oppure una complicanza della varicella. E’ favorita dalla somministrazione di aspirina (generalmente usata come antipiretico) ed è presumibilmente causata da un’alterazione della fosforilazione ossidativa mitocondriale su base tossica. Colpisce generalmente bambini di età compresa fra 4 e 12 anni e rappresenta, nei paesi occidentali, una delle più comuni encefalopatie infantili legate a virus e potenzialmente letali. E’ caratterizzata da vomito, disturbi della coscienza (delirio, stupore o coma), modesta epatomegalia anitterica, massivo rilascio di enzimi epatici e muscolari nel sangue (transaminasi, lattico deidrogenasi, creatina chinasi, glutammico deidrogenasi), allungamento del tempo di protrombina e comparsa di lesioni istologiche caratteristiche (metamorfosi steatosica microvescicolare degli epatociti). L’iperammoniemia (nei casi gravi l’ammoniemia aumenta più di tre volte rispetto ai valori di riferimento) è precoce, probabilmente dovuta ad una diminuita attività della carbamilfosfato sintetasi e dell’ornitina transcarbamilasi mitocondriali, ed accompagnata ad iperaminoacidemia (glutamina, alanina, lisina), ipocitrullinemia e ipoglicemia. La bilirubina e la fosfatasi alcalina sieriche sono nei limiti della norma o solo lievemente aumentate.
6.1c. Iperammoniemia secondaria ad un errore congenito del metabolismo.
Il deficit di uno degli enzimi costituenti il ciclo dell’urea
è la causa genetica più frequente dell’iperammoniemia
infantile (1:30.000 nati vivi). Altri dismetabolismi ereditari
che causano un aumento notevole dell’ammoniemia sono dovuti
ad un alterato trasporto dell’ornitina dal citoplasma nei
mitocondri
![]() o ad errori nel metabolismo della lisina
o ad errori nel metabolismo della lisina
![]() o degli acidi
organici (vedi Tab. 6.I).
o degli acidi
organici (vedi Tab. 6.I).
Tab. 6.I. Errori metabolici congeniti causanti iperammoniemia
| Deficit degli enzimi del ciclo dell’urea | |
| Carbamilfosfato sintetasi | |
| N-acetilglutammato sintetasi | |
| Ornitina transcarbamilasi | |
| Argininosuccinato sintetasi (citrullinemia) | |
| Argininosuccinato liasi (argininosuccinatemia) | |
| Arginasi (argininemia) | |
| Alterato trasporto intramitocondriale dell’ornitina | |
| Sindrome da iperornitinemia-iperammoniemia-omocitrullinemia | |
| Disordini del metabolismo della lisina | |
| Intolleranza proteica lisinurica | |
| Iperlisinuria periodica con iperammoniemia | |
| Acidosi organiche | |
| Acidosi propionica | |
| Acidosi metilmalonica | |
| Acidosi isovalerica | |
| Deficit di chetotiolasi | |
| Deficit multiplo di carbossilasi | |
| Deficit di acil-CoA deidrogenasi (acidosi glutarica tipo II) | |
| Acidosi 3-idrossi-3-metilglutarica | |
Queste alterazioni metaboliche su base genetica devono essere distinte dalla iperammoniemia transiente del neonato, un’alterazione metabolica spesso asintomatica che è frequentemente presente in neonati prematuri con disturbi respiratori e sottoposti ad alimentazione parenterale e che è probabilmente dovuta ad una ritardata maturazione dei sistemi enzimatici, a disfunzioni epatiche causate dall’ipossia o all’uso di preparati contenenti ammoniaca per via parenterale. I sintomi clinici (se presenti) sono simili nelle diverse forme morbose e sono in gran parte dovuti all’encefalopatia conseguente al dismetabolismo dell’ammoniaca (rifiuto del cibo, vomito, tachipnea, convulsioni, letargia, coma profondo). Nei pazienti con acidosi organiche, l’iperammoniemia è usualmente associata ad una severa acidosi, a neutropenia ed a trombocitopenia. Spesso sono presenti epatomegalia ed infezioni generalizzate. L’ammoniemia è usualmente superiore a 400 µmol/L; l’azoto ureico plasmatico è basso.
6.1.1. Metodi di determinazione
L’ammoniaca è dosabile nei liquidi biologici mediante una titolazione dell’analita dopo sua separazione dalle altre componenti, mediante l’uso di membrane selettive o mediante metodiche enzimatiche.
6.1.1a. Separazione e titolazione dell’analita
L’ammoniaca può essere separata mediante diffusione isotermica od uso di resine a scambio ionico. Nel primo caso, l’ammoniaca, liberata dal campione biologico mediante aggiunta di carbonato di potassio, viene catturata da una soluzione di acido cloridrico diluito contenuta in una speciale vaschetta chiusa a doppia camera (microdiffusore di Conway). Nel secondo caso, l’ammoniaca contenuta nel campione biologico viene prima adsorbita su una resina cationica forte e poi eluita con idrato di sodio diluito.
La soluzione contenente l’ammoniaca purificata viene titolata con alcali in presenza di un indicatore (se ottenuta per diffusione isotermica) o colorimetricamente mediante i reattivi di Nessler o di Bertholot. Il reattivo di Nessler, costituito da una soluzione alcalina di ioduro di mercurio e di potassio, reagisce con l’ammoniaca formando ioduro ammonico bimercurico, in soluzione allo stato colloidale e quindi instabile ad alte concentrazioni, che dà un colore da giallo ad arancione scuro misurabile spettrofotometricamente a 450 nm.
![]()
Il reattivo di Berthelot, comprendente una soluzione di fenolo e nitroprussiato di sodio e una soluzione alcalina di ipoclorito di sodio, forma in presenza di ammoniaca un cromoforo blu (indofenolo) misurabile spettrofotometricamente a 560 nm.
![]()
I metodi di dosaggio utilizzanti la diffusione isotermica dell’ammoniaca (non più in uso nei laboratori di biochimica clinica) sono poco accurati in quanto la prolungata alcalinizzazione determina la formazione di ammoniaca da altri composti azotati presenti nel campione e quindi una sovrastima dell’analita. La separazione dell’ammoniaca mediante resine a scambio ionico è più accurata ma spesso poco riproducibile a causa della complessità del metodo.
La reazione di Nessler è circa dieci volte meno sensibile della reazione di Berthelot e può essere alterata dalla presenza di acetone nel campione (ad esempio in paziente con acidosi diabetica).
6.1.1b. Diffusione attraverso membrane selettive
Il dosaggio dell’ammoniaca può essere fatto mediante l’uso di elettrodi selettivi. L’ammoniaca è liberata dal campione mediante alcalinizzazione e lasciata diffondere attraverso una membrana idrofobica permeabile a questo gas (fino all’equilibrazione delle pressioni parziali nei due compartimenti) in una soluzione acquosa di cloruro d’ammonio in cui l’analita si scioglie parzialmente. Il conseguente aumento di pH è misurato potenziometricamente per mezzo di un elettrodo a vetro contro un elettrodo di riferimento argento/cloruro d’argento.
Un’altro metodo (analisi in fase solida su lastrine a perdere) è basato sulla migrazione selettiva dell’ammoniaca attraverso una membrana semipermeabile verso un indicatore di pH (blu di bromofenolo) che vira in blu proporzionalmente alla concentrazione dell’analita. Il colore è misurato mediante spettrofotometria a riflessione a 600 nm.
Questi metodi hanno una buona precisione e una buona accuratezza e sono particolarmente adatti ad essere applicati su apparecchi automatici. L’uso di elettrodi selettivi è attualmente limitato a causa del costo e della breve durata del sensore.
6.1.1c. Dosaggio enzimatico
Questo metodo di comune uso utilizza la reazione catalizzata dalla glutammico deidrogenasi (GDH) per il dosaggio dell’ammoniaca in campioni non deproteinizzati.
![]()
L’ossidazione del NADPH è seguita spettrofotometricamente a 340 nm. L’aggiunta di adenosina difosfato (ADP) alla miscela di reazione serve per stabilizzare l’enzima la cui attività e struttura quaternaria sono influenzati dalla presenza del nucleotide.
Il dosaggio enzimatico dell’ammoniaca è accurato e rapido e mostra una eccellente correlazione con i metodi precedentemente descritti. Interferenze possono essere causate da farmaci (levodopa, cefalotina) che inibiscono l’attività della glutammico deidrogenasi.
6.1.2. Preparazione del campione ed intervalli di riferimento
Il sangue deve essere raccolto (preferibilmente in provette in cui è stato praticato il vuoto) in presenza di ossalato di potassio, EDTA o eparina, riducendo al minimo la stasi durante la flebotomia. Il sangue deve essere posto in un bagno di ghiaccio ed immediatamente centrifugato. Il plasma deve essere completamente rimosso dalle cellule e conservato a 0-5°C (se l’analisi verrà effettuata entro tre ore). Il campione è stabile per 24 ore a -20°C. Nel caso che sia stata utilizzata l’eparina al momento del prelievo, è necessario correggere il valore dell’ammoniemia per l’ammoniaca eventualmente contenuta nell’anticoagulante.
Poiché la concentrazione di ammoniaca nei globuli rossi è circa 2,8 volte più elevata rispetto al plasma, i campioni con un’apprezzabile emolisi devono essere scartati. Nei campioni di sangue lasciati a temperatura ambiente la concentrazione dell’ammoniaca aumenta notevolmente in breve tempo per deaminazione di composti labili; per questo motivo il siero non è un campione accettabile. Deve essere inoltre evitato ogni possibile inquinamento del campione con ammoniaca presente nell’ambiente. Il paziente non deve aver fumato da almeno 6 ore in quanto il fumo determina un apprezzabile aumento dell’ammoniemia.
L’intervallo di riferimento dell’ammoniemia per soggetti sani e adulti è di 18-72 µmol/L. Alcuni studi riportano valori dell’ammoniemia più bassi del 10% nelle femmine rispetto ai maschi. In età pediatrica, vengono comunemente considerati normali i valori di ammoniemia inferiori a 20-35 µmol/L.
6.2. UREA
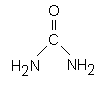
Fig. 6.2. Urea
La concentrazione dell’urea nel sangue è un indice molto sensibile ma non specifico della funzionalità renale, essendo dipendente non solo dalla sua clearance attraverso questo emuntorio ma anche dal contenuto in proteine della dieta, dalla velocità di distruzione delle proteine tessutali e dall’efficienza del metabolismo epatico. La determinazione della concentrazione dell’urea nel sangue è perciò, dal punto di vista clinico, meno convincente rispetto alla determinazione della creatininemia (vedi Par. 6.4). L’urea e la creatinina aumentano simultaneamente nel sangue nel corso di una insufficienza renale (il rapporto fra le concentrazioni ematiche di queste sostanze rimane pressoché invariato e simile a quello riscontrabile in un soggetto normale). Il rapporto urea/creatinina nel sangue tende ad aumentare in caso di un’emorragia intestinale o di un eccessivo apporto proteico alimentare in un soggetto con una funzionalità renale insufficiente, mentre diminuisce nel corso di una dieta ipoproteica o a seguito di una grave insufficienza epatica.
6.2.1. Metodi di determinazione
L’urea è dosabile nei liquidi biologici direttamente come tale o dopo idrolisi enzimatica.
6.2.1a. Determinazione diretta dell’analita.
L’urea può essere determinata spettrofotometricamente con la diacetil monossima. Questo reattivo si idrolizza in diacetile e idrossilamina. Il diacetile condensa con l’urea formando una diazina gialla che assorbe a 550 nm ma che è poco stabile nel tempo (Fig. 6.3). La reazione può essere facilitata eliminando l’idrossilamina formatasi durante la prima fase con persolfato di potassio. La stabilità del cromoforo può essere aumentata con l’aggiunta di tiosemicarbazide. Numerosi composti che contengono un residuo di urea nella loro struttura (ad esempio la citrullina, l’alossana, l’allantoina) reagiscono con il diacetile formando prodotti di reazione colorati che possono causare, se sufficientemente concentrati, una sovrastima dell’urea. La creatinina e le proteine danno luogo a cromofori con uno spettro di assorbimento differente e perciò non determinano alcuna interferenza.
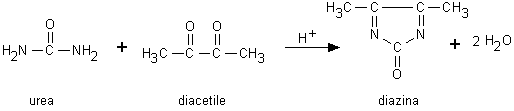
Fig. 6.3. Determinazione dell’urea con la diacetil monossima
L’urea può inoltre reagire con l’o-ftalaldeide formando l’isoindolina. Quest’ultima, in presenza di una chinolina complessa, dà luogo a un cromoforo che assorbe a 510 nm. Questa reazione colorata è stata sfruttata nell’allestimento di strisce reattive di carta per la determinazione dell’urea in fase solida.
6.2.1b. Idrolisi enzimatica dell’urea.
L’urea è idrolizzata ad ammoniaca ed anidride carbonica in presenza di ureasi.
![]()
La reazione può essere seguita misurando l’aumento di conduttività dovuto alla formazione di carbonato d’ammonio in soluzione. Questo metodo è stato applicato su apparecchi automatici e permette di analizzare sia campioni di urina che di sangue.
In alternativa, è possibile dosare l’ammoniaca (prodotta dalla reazione catalizzata dall’ureasi) mediante titolazione chimica, membrane selettive o la reazione enzimatica della glutammico deidrogenasi (Par. 6.1.1c).
Le reazioni di Nessler e di Berthelot per la titolazione chimica dell’ammoniaca sono raramente adoperate a causa della loro scarsa specificità e della difficile applicabilità su apparecchi automatici.
Sensori specifici per l’urea (ma raramente usati nei laboratori di biochimica clinica) sono stati ottenuti legando covalentemente l’ureasi su una matrice solida applicata su un elettrodo avente una membrana selettiva per l’ammoniaca e adatto per la misura potenziometrica di questo gas. Più frequentemente usati sono i metodi che prevedono l’uso di uno spettrofotometro a riflessione e di lastrine a perdere predisposte per la determinazione dell’urea in fase solida e formate da una matrice contenente ureasi immobilizzata, una membrana selettiva per l’ammoniaca e un indicatore di pH.
L’ammoniaca eventualmente contenuta nei reagenti può determinare una sovrastima dell’urea quando è usato il sistema di reazioni catalizzate dall’ureasi e dalla glutammico deidrogenasi. Il metodo dà risultati più accurati se viene misurata, mediante il sistema di reazioni accoppiate, la velocità d’idrolisi dell’urea durante lo stato stazionario e non la quantità totale di ammoniaca ottenibile da questo analita. Infatti, l’ammoniaca esogena è rapidamente consumata dalla glutammico deidrogenasi e non interferisce con la fase lineare della reazione. La determinazione cinetica dell’urea è frequentemente adoperata nei laboratori biochimico-clinici e facilmente adattabile a strumenti automatici di analisi.
6.2.2. Preparazione del campione ed intervalli di riferimento
Plasma (con anticoagulanti) e siero possono essere indifferentemente usati per il dosaggio dell’urea. Il fluoruro di sodio non può essere adoperato come anticoagulante quando si usa un metodo utilizzante l’ureasi in quanto questo enzima è inibito dal fluoruro. Eparina contenente sali d’ammonio non può essere ovviamente impiegata nei metodi basati sulla determinazione dell’ammoniaca. I campioni devono essere conservati a 0-5°C per evitare la degradazione batterica dell’urea.
E’ attualmente ancora diffuso l’uso di esprimere la concentrazione dell’urea in termini di milligrammi di azoto ureico per decilitro. La concentrazione dell’urea (mmol/L) può essere facilmente ottenuta da questi dati tenendo presente il peso molecolare dell’urea (60,06), il peso atomico dell’azoto (14) e il contenuto in azoto dell’urea (due atomi di azoto per molecola). L’intervallo di riferimento per l’urea nel siero dipende dal metodo di dosaggio. Utilizzando la diacetil monossima, sono stati ottenuti negli adulti valori di 2,5 - 8,0 mmol/L per i maschi e di 2,0 – 7,5 mmol/L per le femmine. I neonati hanno concentrazioni di urea nel siero leggermente inferiori rispetto ai bambini più grandi e rispetto agli adulti (1,0 – 7,5 mmol/L).
6.3. CREATINA
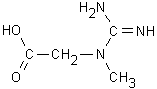
Fig. 6.4. Creatina
Un aumento della creatina sierica, o della velocità di
escrezione renale di questa sostanza, è osservabile in seguito a
traumi acuti o malattie croniche dei muscoli (sempre nella distrofia muscolare progressiva
![]() , spesso nella
miastenia grave, raramente nella
miotonia congenita). Un aumento della
creatinuria si riscontra inoltre nell’artrite reumatoide
, spesso nella
miastenia grave, raramente nella
miotonia congenita). Un aumento della
creatinuria si riscontra inoltre nell’artrite reumatoide
![]() e
nel corso di situazioni che comportano un aumento del catabolismo
muscolare (esercizio fisico prolungato, malnutrizione, febbre,
ipertiroidismo, diabete).
e
nel corso di situazioni che comportano un aumento del catabolismo
muscolare (esercizio fisico prolungato, malnutrizione, febbre,
ipertiroidismo, diabete).
La necessità clinica di un dosaggio della creatina è molto limitata in quanto esistono attualmente saggi di altri analiti (in particolare la creatina chinasi e l’aldolasi sieriche; vedi Par. 9) più specifici, sensibili e tecnicamente più accurati per evidenziare alterazioni del metabolismo muscolare. La creatina contenuta nei globuli rossi è dosata al fine di determinare il tempo di vita di queste cellule.
Una grave diminuzione della concentrazione di creatina nel tessuto muscolare e nervoso viene osservata nelle
sindromi da deficit di creatina
![]() che si accompagnano a ritardo dello sviluppo
psicomotorio, ipotonia muscolare, alterazioni
extrapiramidali ed epilessia.
che si accompagnano a ritardo dello sviluppo
psicomotorio, ipotonia muscolare, alterazioni
extrapiramidali ed epilessia.
6.3.1. Metodi di determinazione
La creatina può essere dosata nei fluidi biologici, direttamente come tale o dopo averla convertita in creatinina, oppure a livello dei tessuti.
6.3.1a. Determinazione diretta della creatina.
La creatina reagisce con il diacetil-1-naftolo in ambiente alcalino dando luogo alla formazione di un cromoforo rosso. La velocità della reazione dipende dalla temperatura e il massimo di assorbimento del prodotto colorato tende a spostarsi nel tempo verso lunghezze d’onda superiori. I derivati della guanidina possono interferire con il saggio (risultati falsamente elevati sono ottenuti in pazienti con insufficienza renale per accumulo di tali composti nel sangue).
La creatina può inoltre essere misurata fluorimetricamente (eccitazione a 400 nm, emissione a 505 nm) facendola reagire con la ninidrina. Questo metodo di dosaggio è raramente usato per la sua scarsa precisione dovuta all’instabilità e all’elevato valore della fluorescenza iniziale dei reattivi.
Una determinazione enzimatica della creatina si basa sulla misura spettrofotometrica (a 340nm) del NADH consumato nel corso delle seguenti reazioni accoppiate:
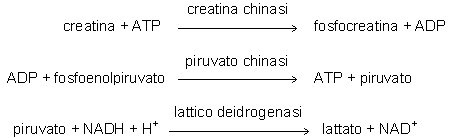
Il metodo è potenzialmente accurato. Risultati falsamente elevati possono essere ottenuti per la presenza di ADP (nella preparazione di ATP) o di piruvato (nella preparazione del fosfoenolpiruvato). Un’insufficiente attività della creatina chinasi (che è instabile nel tempo) può portare invece ad una sottostima dell’analita. Altri metodi enzimatici per la determinazione della creatina sono basati sulle seguenti reazioni accoppiate:

La formaldeide, prodotto della sequenza di reazioni, può essere misurata spettrofotometricamente (a 340 nm) in presenza di NAD+ e formaldeide deidrogenasi.
![]()
In alternativa, si può dosare il perossido di idrogeno (anch’esso prodotto nel corso della reazione catalizzata dalla sarcosina ossidasi) facendolo reagire con il 4-amino-3-idrazino-5-mercapto-1,2,4-triazolo e dando così luogo alla formazione di un cromoforo viola che assorbe 550 nm. Un altro metodo per il dosaggio del perossido di idrogeno consiste nell’uso di una tecnica polarografica.
6.3.1b. Conversione della creatina in creatinina.
Il campione viene acidificato (con acido picrico) e scaldato per facilitare la condensazione della creatina in creatinina. La creatinina è dosata con il reattivo di Jaffé (vedi Par. 6.4.1a). Questo metodo, sebbene comunemente usato, presenta numerosi svantaggi. Una trasformazione incompleta della creatina in creatinina (per temperatura, pH o tempo di incubazione inadeguati) può portare ad una sottostima dell’analita. Poichè la concentrazione di creatinina nel siero è circa due volte la concentrazione della creatina, è necessario determinare la creatininemia prima di acidificare il siero. La reazione di Jaffé è di per se stessa imprecisa ed inaccurata e l’acidificazione del campione aumenta il numero e la concentrazione dei cromogeni interferenti.
6.3.1c. Determinazione della creatina a livello dei tessuti.
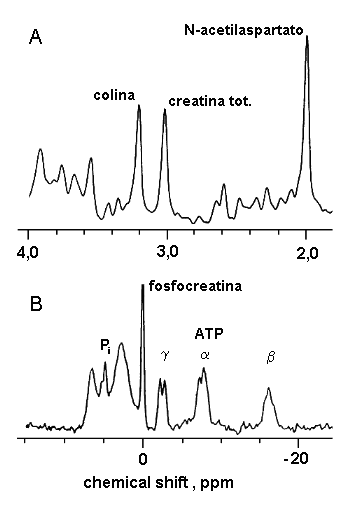
La concentrazione della creatina nei tessuti (muscolo, cervello) può essere determinata in vivo mediante spettroscopia di risonanza magnetica. Questa tecnica, disponibile attualmente solo presso centri ad alta specializzazione, è particolarmente innovativa in quanto consente di esplorare direttamente sul paziente e in modo non invasivo la concentrazione intracellulare di diversi metabolici e la funzionalità di vie metaboliche specifiche (Fig. 6.5).
La spettroscopia di risonanza magnetica del protone del tessuto cerebrale è utilizzata nello studio di pazienti con sindromi da deficit di creatina. Nei soggetti di controllo e nei pazienti trattati con creatina esogena, la tecnica permette di evidenziare il segnale di risonanza del gruppo CH3 della creatina totale (3,03 ppm), come somma di creatina più fosfocreatina. Altri segnali che dominano lo spettro di risonanza sono quelli attribuibili al CH3 del gruppo N-acetile (2,02 ppm), in gran parte presente come N-acetil aspartato, e al N(CH3)3 della colina (3,24 ppm), presente principalmente come fosforilcolina e glicerofosforilcolina.
La spettroscopia di risonanza del fosforo fornisce indicazioni utili allo studio del metabolismo lipidico e del metabolismo energetico cellulare. Il segnale della fosfocreatina è ben evidenziabile nel muscolo e nel cervello. Segnali di minore intensità sono attribuibili all’ATP e al fosfato inorganico. Dal "chemical shift" dei segnali è possibile risalire al pH ed alla concentrazione intracellulare dello ione magnesio.
6.3.2. Preparazione del campione ed intervalli di riferimento
Poiché la concentrazione di creatina nei globuli rossi è molto più elevata rispetto al siero, i campioni con un’apprezzabile emolisi devono essere scartati. Nelle urine la concentrazione di creatina varia molto nel tempo (anche a freddo) a causa della sua reversibile trasformazione spontanea in creatinina. Allo scopo di aumentare la stabilità del campione si consiglia perciò di neutralizzare l’urina prima di conservarla congelata.
Gli intervalli di riferimento per la creatina sierica, urinaria ed eritrocitaria sono riportati in Tab. 6.II. Vi sono notevoli divergenze in letteratura riguardo ai valori di riferimento per la creatina urinaria (probabilmente essa deriva in parte da un’idrolisi della creatinina nella vescica). L’escrezione urinaria di creatina nelle donne è irregolare e, nell’8% dei casi, più del doppio rispetto a quella dei maschi. L’escrezione urinaria aumenta durante la gravidanza e il puerperio.
Tab. 6.II. Intervallo di riferimento per la creatina. I valori sono espressi in µmol/L (mg/L). La escrezione urinaria di creatina nelle donne è irregolare; nell’8% dei casi l’escrezione è più del doppio rispetto ai maschi.
maschi |
femmine |
|
| siero | 15 – 45 (2,0 – 5,9) |
30 – 80 (3,9 – 10) |
| urine | < 350 (< 46) |
< 700 (< 92) |
| eritrociti | 320 – 610 (42 – 80) |
380 – 730 (50 – 100) |
6.4. CREATININA
Fig. 6.6. Creatinina
La produzione endogena di creatinina è proporzionale alla massa muscolare ed
è
grossolanamente costante nel tempo e scarsamente dipendente dal contenuto
proteico della dieta (in una persona di 70 kg la creatinina è prodotta alla
velocità di circa 1,2 mg/min ossia 1,7 g/die). Poiché l’escrezione della creatinina
dipende essenzialmente dall’emuntorio renale, il suo livello nel siero è un
indice sensibile e specifico della funzionalità del rene. La concentrazione
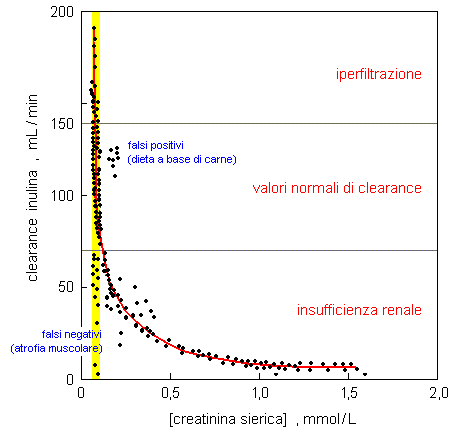
della creatinina nel siero varia con un andamento approssimativamente iperbolico
al variare della velocità di filtrazione glomerulare (Fig. 6.7).
Questa può essere determinata misurando la clearance (definita come il
volume di plasma da cui un analita può essere completamente eliminato nelle
urine per unità di tempo) di una sostanza esogena, come ad esempio l’inulina,
che possa essere iniettata nel sangue e che goda della proprietà di distribuirsi
nello spazio extracellulare senza legarsi alle proteine plasmatiche, di non
essere metabolizzabile dall’organismo e di essere ultrafiltrabile dal rene senza
essere riassorbita o escreta dai tuboli
![]() .
.
Fig. 6.7. Uso della creatinina come indice di funzionalità renale. La velocità di filtrazione glomerulare (espressa come clearance dell’inulina) è funzione iperbolica della concentrazione sierica della creatinina. Livelli abnormemente elevati di creatinina possono essere osservati in pazienti che hanno seguito una dieta a base di carne, mentre valori abnormemente bassi sono riscontrabili in caso di atrofia muscolare. La barra di colore giallo delimita l’intervallo di riferimento per la concentrazione della creatinina nel siero in un soggetto adulto di sesso maschile.
La velocità di filtrazione glomerulare può essere valutata più semplicemente misurando la clearance della creatinina ed evitando così di dover iniettare nel paziente una sostanza esogena. Tuttavia, a causa di una modesta secrezione tubolare della creatinina, la misura della sua clearance porta ad una sovrastima della velocità di filtrazione glomerulare di circa il 15%; per la medesima ragione, a basse velocità di filtrazione, la clearance della creatinina non è più proporzionale alla velocità di filtrazione glomerulare.
In caso di sospetta insufficienza renale acuta o cronica, la determinazione della concentrazione della creatinina nel siero è comunque, dal punto di vista clinico, più convincente rispetto alla determinazione dell’urea (vedi Par. 6.2). A differenza della creatinina, la determinazione della clearance dell’urea porta a sottostimare la velocità di filtrazione glomerulare in quanto questo catabolita è in parte riassorbito dai tuboli (vedi Par. 6)
6.4.1. Metodi di determinazione
La creatinina è direttamente dosabile nei liquidi biologici mediante metodi chimici o enzimatici o dopo una sua purificazione.
6.4.1a. Determinazione diretta della creatinina.
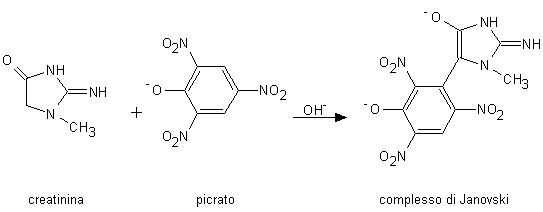
Il saggio di Jaffé è basato sulla reazione di condensazione fra creatinina e picrato di sodio che dà luogo in ambiente alcalino ad un cromoforo rosso (complesso di Janovski; Fig. 6.8). Quest’ultimo, malgrado abbia un massimo di assorbimento a 485 nm, è generalmente dosato spettrofotometricamente a 510-520 nm per minimizzare l’interferenza dovuta al picrato (anch’esso colorato e presente in eccesso nella miscela di reazione). Numerose sostanze (acido ascorbico, glucoso, fruttoso, acido urico, acido aminoippurico, acido piruvico, acido α-chetoglutarico, acido acetoacetico, acetone, cefalosporine, aminoacidi, proteine e ogni altro composto capace di ridurre il picrato a picramato o contenente un gruppo metile o metilene attivo) interferiscono con il dosaggio della creatinina formando prodotti fortemente colorati. Temperature superiori a 30°C determinano un aumento del coefficiente di assorbimento sia del picrato e che del prodotto di reazione fra creatinina e picrato ma facilitano anche la formazione di sostanze colorate interferenti. La bilirubina e gli altri prodotti del catabolismo dell’eme causano invece una sottostima dell’analita probabilmente in quanto vengono ossidati in ambiente alcalino e trasformati in composti incolori. A causa della scarsa specificità della reazione, circa il 20% del colore che si sviluppa in un siero deproteinizzato e circa il 5% di quello che si sviluppa nelle urine sono dovuti a sostanze interferenti. Queste percentuali possono essere più elevate quando vengono presi in considerazione campioni patologici, come ad esempio sangue prelevato da soggetti in acidosi diabetica contenente alte quantità di acido acetoacetico (circa il 40% dei pazienti con grave insufficienza renale ha un diabete). Alcune delle interferenze possono essere minimizzate con una procedura che prevede la misura della velocità di formazione del complesso fra creatinina e picrato (invece della quantità totale di cromoforo ad equilibrio) mediante due successive determinazioni spettrofotometriche. La prima viene fatta dopo 10-60 secondi dall’aggiunta del reattivo in modo da permettere l’eliminazione delle sostanze interferenti che reagiscono rapidamente con il picrato (ad esempio almeno parte dell’acetoacetato). La seconda misura viene effettuata dopo 16-120 secondi (prima che la reazione vada a termine) in modo da evitare che sostanze che reagiscono lentamente con il picrato, come le proteine, possano interferire molto nella determinazione della creatinina.
Fig. 6.8. Reazione di Jaffé
In alternativa, la creatinina può essere dosata in presenza di 1,4-naftochinone-2-sulfonato, di o-nitrobenzaldeide o di acido 3,5-dinitrobenzoico. Quest’ultimo reagente, che dà luogo ad un prodotto di reazione rosa violaceo in ambiente alcalino, può essere utilizzato in analisi in fase solida su lastrine a perdere mediante spettrofotometria a riflessione.
6.4.1b. Dosaggio enzimatico.
La creatinina è dosabile spettrofotometricamente (a 340 nm) dopo la sua conversione enzimatica in creatina mediante le reazioni accoppiate catalizzate dalla creatina chinasi, piruvato chinasi e lattico deidrogenasi, come descritto nel Par. 6.3.1a.
![]()
L’ADP e il piruvato eventualmente presenti nelle preparazioni commerciali dei reattivi possono determinare una sovrastima dell’analita. Le interferenze da ADP e piruvato possono essere minimizzate preincubando opportunamente la miscela di reazione prima dell’aggiunta della creatinina amidoidrolasi. Il metodo è stato adattato per analisi su apparecchi automatici. Un altro metodo enzimatico per il dosaggio della creatinina sfrutta la reazione catalizzata dalla creatinina deiminasi:
![]()
L’ammoniaca prodotta nel corso della reazione può essere dosata attraverso l’uso della glutammico deidrogenasi, di elettrodi specifici o di lastrine multistrato (vedi Par. 6.1.1). Queste ultime sono formate da una matrice contenente la creatinina deiminasi immobilizzata, una membrana permeabile all’ammoniaca e un indicatore di pH, il cui viraggio è seguito mediante spettrofotometria per riflessone (analisi in fase solida su lastrine a perdere). Pazienti trattati con 5-fluorocitosina hanno valori falsamente elevati di creatininemia se questa è dosata mediante spettrofotometria a riflessione. Tutti i metodi che prevedono il dosaggio dell’ammoniaca danno risultati che devono essere corretti per l’ammoniaca presente inizialmente nel campione.
6.4.1c. Purificazione dell’analita.
Di uso relativamente frequente è il metodo che prevede la precipitazione delle proteine presenti nel campione e l’adsorbimento della creatinina su silicato di alluminio e magnesio in sospensione colloidale (bentonite, reagente di Lloyd). Dopo centrifugazione e decantazione del supernatante contenente molte delle sostanze interferenti (solo il piruvato e l’α-chetoglutarato, se molto concentrati, sono presenti ancora nel residuo insolubile), il precipitato viene trattato con il reattivo di Jaffé.
Altri metodi, usati più raramente, sono basati su tecniche cromatografiche a bassa pressione richiedenti l’uso di resine cationiche o su tecniche cromatografiche ad alta pressione a scambio ionico o in fase inversa. La creatinina purificata viene determinata mediante il reattivo di Jaffé o misurando direttamente il suo assorbimento a 200 nm.
6.4.2. Preparazione del campione ed intervalli di riferimento
La creatinina può essere dosata su plasma, siero o urine diluite. Gli anticoagulanti comunemente usati (fluoruro, eparina) non causano generalmente interferenze. Tuttavia, se la creatinina viene determinata mediante il dosaggio dell’ammoniaca prodotta ad opera della creatinina deiminasi, è necessario evitare preparazioni di eparina contenenti ammoniaca. Quando si impiega questo tipo di dosaggio bisogna inoltre rimuovere rapidamente il plasma dai globuli rossi ed eseguire rapidamente l’analisi onde evitare che aumenti il contenuto di ammoniaca endogena nel campione (vedi Par. 6.1.2). Se il campione è analizzato mediante il reattivo di Jaffé, è stabile per almeno una settimana a 4°C.
La concentrazione della creatinina nel sangue dipende dal
rapporto fra le velocità con cui viene prodotta ed escreta.
Poichè questo analita deriva in massima parte dalla creatina e
dalla fosfocreatina muscolare, più grande sarà la massa
muscolare del soggetto in esame, più elevata sarà la sua
creatininemia. Per quanto riguarda l’escrezione della
creatinina, questa dipende in massima parte dalla filtrazione
attraverso i glomeruli renali. Se usata come misura della
funzionalità renale, la determinazione della clearance
della creatinina (generalmente effettuata sulle urine delle 24
ore) è molto più sensibile rispetto alla determinazione della
sua concentrazione ematica. Opportunamente corretti per la
superficie corporea (che è a sua volta approssimativamente
proporzionale alla superficie di filtrazione glomerulare e che è
ricavabile dal peso e dall’altezza del paziente mediante
apposite tabelle)
![]() , i
valori di riferimento della clearance renale della
creatinina si mantengono costanti dalla pubertà fino ai
cinquanta anni, diminuendo poi gradatamente. I bambini hanno
generalmente valori di clearance per unità di superficie
corporea più bassi rispetto i soggetti postpuberi. I valori di
riferimento sono riportati in Tab. 6.III.
, i
valori di riferimento della clearance renale della
creatinina si mantengono costanti dalla pubertà fino ai
cinquanta anni, diminuendo poi gradatamente. I bambini hanno
generalmente valori di clearance per unità di superficie
corporea più bassi rispetto i soggetti postpuberi. I valori di
riferimento sono riportati in Tab. 6.III.
Tab. 6.III. Intervallo di riferimento per la creatinina e la clearance della creatinina. I valori nel siero sono espressi in µmol/L (mg/L). La clearance, aggiustata per peso ed altezza, è espressa in mL/min.
| Età | siero |
clearance |
| < 12 anni | 22-75 (2,5-8,5) |
50-90 |
| adulti maschi | 57-92 (6,4-10,4) |
97-137 |
| adulti femmine | 50-81 (5,7-9,2) |
88-128 |
| aggiornamento: 03/01/11 |