|
|
Costantino Salerno |
|
|
Appunti di Biochimica Clinica |
|
|
9. ENZIMI PLASMATICI
Il plasma contiene numerosi enzimi, la cui attività è molto costante nel soggetto sano, probabilmente per un equilibrio dinamico tra l’entrata in circolo di nuove molecole enzimatiche dalle cellule e l’inattivazione o l’allontanamento di quelle preesistenti attraverso il filtro renale o il sistema reticolo-endoteliale. La concentrazione degli enzimi nel plasma è notevolmente inferiore a quella riscontrabile nelle cellule. L’elevato gradiente di concentrazione è dovuto all’efficienza dei meccanismi di membrana. Se questa efficienza diminuisce (per ipossia, azione di sostanze tossiche, etc.) può verificarsi un passaggio di enzimi dalle cellule al plasma e le attività enzimatiche in quest’ultimo compartimento possono modificarsi in modo tanto caratteristico da poter indicare con una qualche esattezza l’organo da cui gli enzimi stessi provengono (enzimogramma d’organo). Generalmente, il quadro con il tempo si rende più complesso per eventuali ricadute o estensioni del processo patologico originario e per le notevoli differenze nella velocità con cui gli enzimi vengono allontanati dal plasma.
La facilità con cui gli enzimi sono rilasciati dai tessuti dipende almeno in parte dalla loro localizzazione intracellulare. Gli enzimi citoplasmatici (lattico deidrogenasi, aspartato aminotrasferasi citoplasmatica, aldolasi) escono più facilmente e precocemente dalla cellula rispetto a quelli microsomiali (γ-glutamiltranspeptidasi, arilesterasi, glucosio-6-fosfatasi) o mitocondriali (glutammico deidrogenasi, aspartato aminotrasferasi mitocondriale). Un altro fattore che influisce sul livello plasmatico degli enzimi è la velocità con cui sono sintetizzati dai tessuti, che può essere ridotta (come nel caso della colinesterasi nelle cirrosi epatica) o aumentata (come nel caso della fosfatasi alcalina nelle condizioni di iperattività osteoblastica).
9.1. ISOENZIMI
Il termine isoenzimi è riservato a quelle forme multiple di
enzimi, che pur avendo la stessa attività catalitica presentano
una diversa struttura primaria
![]() . Gli isoenzimi possono essere
dei monomeri o degli omopolimeri geneticamente indipendenti
oppure degli eteropolimeri di due o più catene polipeptidiche.
Gli isoenzimi sono identificati e quantizzati in base alle loro
differenti proprietà fisico-chimiche. L’elettroforesi è
raccomandata come base per la loro classificazione perché è una
tecnica ampiamente usata e ad alto potere risolutivo. Un
particolare isoenzima può essere organo-specifico e una
variazione della sua concentrazione plasmatica può consentire di
identificare il tessuto coinvolto nel processo patologico.
. Gli isoenzimi possono essere
dei monomeri o degli omopolimeri geneticamente indipendenti
oppure degli eteropolimeri di due o più catene polipeptidiche.
Gli isoenzimi sono identificati e quantizzati in base alle loro
differenti proprietà fisico-chimiche. L’elettroforesi è
raccomandata come base per la loro classificazione perché è una
tecnica ampiamente usata e ad alto potere risolutivo. Un
particolare isoenzima può essere organo-specifico e una
variazione della sua concentrazione plasmatica può consentire di
identificare il tessuto coinvolto nel processo patologico.
9.1.1. Isoenzimi della lattico deidrogenasi
Nel siero sono generalmente presenti cinque isoenzimi.della
lattico deidrogenasi. Come mostrato in Tab. 9.I,
ciascun isoenzima è un tetramero costituito da una combinazione
di due subunità geneticamente distinte di 35 kDa, denominate H e
M
![]() ,
a formare due omopolimeri (LDH1 e LDH5) e
tre ibridi (LDH2, LDH3, LDH4).
Le catene H ed M hanno diversa composizione aminoacidica e
diverse proprietà cinetiche. All’esame elettroforetico a pH
alcalino, l’isoenzima LDH1 è la frazione più
anodica, mentre l’LDH5 è la frazione catodica più
lenta.
,
a formare due omopolimeri (LDH1 e LDH5) e
tre ibridi (LDH2, LDH3, LDH4).
Le catene H ed M hanno diversa composizione aminoacidica e
diverse proprietà cinetiche. All’esame elettroforetico a pH
alcalino, l’isoenzima LDH1 è la frazione più
anodica, mentre l’LDH5 è la frazione catodica più
lenta.
Tab. 9.I. Composizione degli isoenzimi della lattico deidrogenasi
LDH1 |
HHHH | H4 |
LDH2 |
HHHM | H3M |
LDH3 |
HHMM | H2M2 |
LDH4 |
HMMM | HM3 |
LDH5 |
MMMM | M4 |
In generale, tessuti con un metabolismo prevalentemente aerobio (ad esempio il cuore) sintetizzano una maggiore quota di subunità H, mentre i tessuti con un metabolismo prevalentemente anaerobio (ad esempio il muscolo) sintetizzano una maggiore quota di subunità M (Tab. 9.II).
In molte condizioni patologiche i cinque isoenzimi della
lattico deidrogenasi aumentano contemporaneamente senza far
variare il rapporto reciproco (elevazione isomorfica). Nell’infarto
miocardico acuto, nell’infarto renale acuto e in condizioni
di emolisi l’aumento predominante dell’isoenzima LDH1
porta ad una inversione del rapporto sierico LDH1/LDH2
(flipped LDH) ![]() .
Un aumento dell’isoenzima LDH5 deve invece far
pensare ad un danno epatico o del muscolo scheletrico. Meno
specifico è l’aumento delle forme intermedie che può
osservarsi, ad esempio, nel caso di embolia polmonare.
.
Un aumento dell’isoenzima LDH5 deve invece far
pensare ad un danno epatico o del muscolo scheletrico. Meno
specifico è l’aumento delle forme intermedie che può
osservarsi, ad esempio, nel caso di embolia polmonare.
Tab. 9.II. Distribuzione percentuale degli isoenzimi della lattico deidrogenasi nei tessuti umani
LDH1 |
LDH2 |
LDH3 |
LDH4 |
LDH5 |
|
| cuore | 40 |
35 |
20 |
5 |
0 |
| reni | 35 |
30 |
25 |
10 |
0 |
| cervello | 25 |
35 |
30 |
10 |
0 |
| utero | 5 |
20 |
50 |
20 |
5 |
| polmoni | 5 |
10 |
35 |
35 |
15 |
| tiroide | 5 |
10 |
30 |
30 |
25 |
| milza | 5 |
15 |
30 |
30 |
20 |
| fegato | 0 |
5 |
10 |
15 |
70 |
| muscolo scheletrico | 0 |
0 |
10 |
30 |
60 |
| siero | 25 |
35 |
20 |
10 |
10 |
9.1.2. Isoenzimi della creatina chinasi
La creatina chinasi citoplasmatica
![]() è un
dimero e si presenta sotto forma di tre isoenzimi risultanti
dalle possibili combinazioni di due subunità, B ed M
è un
dimero e si presenta sotto forma di tre isoenzimi risultanti
dalle possibili combinazioni di due subunità, B ed M
![]() ,
di 45 kDa e di diversa composizione aminoacidica (Tab. 9.III). All’esame elettroforetico a
pH alcalino, l’isoenzima CPK1 è la frazione più
anodica, mentre l’isoenzima CPK3 è la frazione
catodica più lenta.
,
di 45 kDa e di diversa composizione aminoacidica (Tab. 9.III). All’esame elettroforetico a
pH alcalino, l’isoenzima CPK1 è la frazione più
anodica, mentre l’isoenzima CPK3 è la frazione
catodica più lenta.
Tab. 9.III. Composizione degli isoenzimi della creatina chinasi
CPK1 |
BB |
B2 |
CPK2 |
BM |
MB |
CPK3 |
MM |
M2 |
La distribuzione percentuale degli isoenzimi della creatina
chinasi nei tessuti è riportata in Tab. 9.IV.
Persino nel corso di danni cerebrovascolari, l’isoenzima CPK1
non è quasi mai presente nel siero. L’isoenzima CPK2
aumenta invece costantemente (nel 100% dei casi) nell’infarto
cardiaco acuto e, in minore misura, negli episodi gravi di angina
o di insufficienza coronarica senza segni di infarto
![]() . Nell’infarto
miocardico, l’isoenzima CPK2 compare nel siero
generalmente 4-8 ore dopo l’episodio acuto e raggiunge un
massimo dopo 24 ore, quando può rappresentare anche il 40% dell’attività
totale della creatina chinasi
. Nell’infarto
miocardico, l’isoenzima CPK2 compare nel siero
generalmente 4-8 ore dopo l’episodio acuto e raggiunge un
massimo dopo 24 ore, quando può rappresentare anche il 40% dell’attività
totale della creatina chinasi
![]() . Dopo 72 ore dall’infarto,
solo il 66% dei pazienti presenta ancora una elevazione (di
minore entità) del CPK2 che scompare in seguito
rapidamente
. Dopo 72 ore dall’infarto,
solo il 66% dei pazienti presenta ancora una elevazione (di
minore entità) del CPK2 che scompare in seguito
rapidamente ![]() .
.
L’isoenzima CPK2 aumenta anche nella distrofia
muscolare, nella polimiosite e in pazienti con mioglobinuria. Un
aumento del CPK3 è osservabile nel siero nei casi di
trauma muscolare, di shock postoperatorio e fino ad oltre 4-5
giorni dopo un infarto cardiaco
![]() .
.
Tab. 9.IV. Distribuzione percentuale degli isoenzimi della creatina chinasi nei tessuti umani
CPK1 |
CPK2 |
CPK3 |
|
| muscolo scheletrico | 0 |
0 |
100 |
| cuore | 0 |
40 |
60 |
| cervello | 90 |
0 |
10 |
| polmoni | 90 |
0 |
10 |
| intestino | 100 |
0 |
0 |
| siero | 0 |
0 |
100 |
9.1.3. Isoenzimi della amilasi
L’amilasi presenta due isoenzimi: il tipo S e il tipo P, codificati da due geni diversi localizzati sul cromosoma 1. Il tipo S si trova nelle ghiandole salivari, nel polmone e negli organi genitali femminili (tube di Falloppio, cisti ovariche, mucosa cervicale). Il tipo P è presente esclusivamente nel pancreas.
Normalmente, nel siero prevale la frazione S (circa il 60%) sulla P (circa il 40%). La concentrazione sierica dell’isoenzima S è molto bassa alla nascita e raggiunge i livelli dell’adulto verso i 5 anni. L’isoenzima P è invece assente nel siero alla nascita e raggiunge i valori dell’adulto verso i 15 anni. Entrambi gli isoenzimi sono eliminati dal sistema reticolo-endoteliale o escreti con le urine, ma con clearance diversa. Per tale motivo nelle urine, a differenza del siero, prevale normalmente l’isoenzima P (escreto con maggiore velocità) sull’isoenzima S.
L’isoenzima P aumenta dopo interventi operatori sull’addome
e, in particolare, sulle vie biliari, dopo colangio-pancreatografia
endoscopica retrograda e nelle pancreatiti acute
![]() ,
mentre diminuisce nelle pancreatiti croniche e nella fibrosi
cistica
,
mentre diminuisce nelle pancreatiti croniche e nella fibrosi
cistica
![]() per riduzione del parenchima pancreatico. La frazione S
aumenta nella parotite
per riduzione del parenchima pancreatico. La frazione S
aumenta nella parotite ![]() e nella sindrome di Sjögren
e nella sindrome di Sjögren
![]() .
Un aumento percentuale della frazione S sulla P è osservabile
negli alcolisti per una azione diretta dell’alcool sulle
parotidi o per l’instaurarsi di una pancreatite cronica
alcolica.
.
Un aumento percentuale della frazione S sulla P è osservabile
negli alcolisti per una azione diretta dell’alcool sulle
parotidi o per l’instaurarsi di una pancreatite cronica
alcolica.
9.1.4. Isoenzimi della fosfatasi alcalina
La fosfatasi alcalina agisce ad un pH ottimale compreso fra 8,6 e 10,3 (a seconda del substrato impiegato) e catalizza l’idrolisi del legame estere fra alcoli ed acido fosforico con liberazione di fosfato inorganico. Questo enzima costituisce un sistema di forme molecolari multiple nel quale l’eterogeneità è dovuta in parte a fattori genetici ed in parte a fattori post-trasduzionali (vedi Par. 9.2). E’ possibile suddividere gli isoenzimi della fosfatasi alcalina in tre gruppi controllati da tre geni strutturali distinti e corrispondenti (1) all’isoenzima placentare, (2) all’isoenzima intestinale e (3) al gruppo degli isoenzimi non placentari - non intestinali (epatico, osseo, renale), che derivano probabilmente da variazioni tessuto-specifiche sul prodotto di un unico gene comune a differenti tipi di cellule. L’eterogeneità all’interno dello stesso tessuto è dovuta a varianti alleliche nel caso dell’isoenzima placentare, o a modificazioni post-trasduzionali della molecola enzimatica negli altri casi.
Ai fini pratici, le diverse forme molecolari sono distinte in
7 frazioni in base alla loro origine: placentare,
carcinoplacentare, intestinale, epatica (denominata anche epatica
principale o epatica lenta), biliare (o epatica veloce), ossea, e
renale. A queste bisogna aggiungere i complessi macromolecolari
costituiti dalle macrofosfatasi. Alcune frazioni (placentare,
intestinale, epatica, ossea) sono presenti normalmente nel siero
![]() ,
mentre altre (carcinoplacentare, biliare, renale e le
macrofosfatasi) costituiscono dei reperti anomali.
,
mentre altre (carcinoplacentare, biliare, renale e le
macrofosfatasi) costituiscono dei reperti anomali.
9.1.4a. Reperti normali
La frazione placentare si differenzia dalle altre per la maggiore stabilità al calore. E’ rilevabile nel siero di donne in gravidanza a partire della 16a - 20a settimana fino a 6 giorni dopo l’espulsione della placenta. Presenta numerose varianti alleliche. Una di queste (variante D), che è presente in meno dell’1% dei casi, si distingue dalle altre perché è inibita dalla leucina e dall’EDTA.
La frazione intestinale è presente nel siero di circa il 25% dei soggetti (più frequentemente negli individui di gruppo sanguigno B e 0) ed è più elevata dopo i pasti. Questa frazione aumenta in varie condizioni morbose interessanti l’apparato digerente (rettocolite emorragica, diarrea cronica, tubercolosi intestinale, disturbi epato-biliari, cirrosi, epatite virale) fino a divenire predominante rispetto alle altre.
La frazione epatica è normalmente presente nel siero ed aumenta quasi costantemente nei vari quadri di patologia epatica (cirrosi, ittero ostruttivo, metastasi epatiche).
La frazione ossea è un’altra componente normale
del siero. Il suo livello è in stretta relazione con l’attività
osteoblastica. Questa frazione è particolarmente elevata nei
bambini e negli adolescenti, ma tende ad aumentare anche negli
anziani e in diverse patologie ossee (tumori primitivi o
secondari di tipo osteoblastico, iperparatiroidismo primario e
secondario, rachitismo, fratture ossee in via di guarigione,
morbo di Paget ![]() ).
).
9.1.4b. Reperti anomali
La frazione carcinoplacentare ha le caratteristiche dell’isoenzima placentare. Una sua forma (isoenzima di Regan) può essere rinvenuta nel siero del 3-15% dei pazienti con vari tipi di carcinoma. Un’altra forma (isoenzima di Nagao) è stata riscontrata nella carcinomatosi pleurica ed è identificabile con la variante D dell’isoenzima placentare.
La frazione biliare, a peso molecolare relativamente
elevato, compare nel siero di pazienti con affezioni epatiche di
tipo ostruttivo (cirrosi epatica, epatiti acute e croniche,
ittero ostruttivo, tumori primitivi e metastatici, granulomi
epatici, sarcoidosi ![]() ).
Nel siero è legata alla lipoproteina X (vedi
Par. 3). A causa della
elevata mobilità elettroforetica su acetato di cellulosa e delle
concomitanti alterazioni epatiche, questa frazione prende anche
il nome di frazione epatica-veloce.
).
Nel siero è legata alla lipoproteina X (vedi
Par. 3). A causa della
elevata mobilità elettroforetica su acetato di cellulosa e delle
concomitanti alterazioni epatiche, questa frazione prende anche
il nome di frazione epatica-veloce.
La frazione renale è presente nel siero solo in alcuni pazienti sottoposti a trapianto renale e non viene normalmente ricercata.
Le macrofosfatasi sono dei complessi fra fosfatasi alcalina e immunoglobuline, generalmente di tipo IgG (vedi Par. 9.3). Il reperto è raro (circa 1 caso ogni 300 analisi isoenzimatiche) ed è riscontrabili in pazienti con affezioni epatiche, polmonari o intestinali.
9.1.5. Isoenzimi della fosfatasi acida
La fosfatasi acida catalizza una reazione analoga a quella descritta per la fosfatasi alcalina (vedi Par. 9.1.4), liberando fosfato inorganico dall’idrolisi del legame estere fra alcoli e acido fosforico, ma agisce ad un pH ottimale compreso fra 4,8 e 6,0. Questo enzima si trova nella prostata (dove, sotto lo stimolo degli ormoni androgeni, raggiunge concentrazioni circa 100 volte superiori agli altri tessuti), nello stomaco, nel fegato, nella milza, nei muscoli, negli eritrociti e nelle piastrine. Nel siero, la fosfatasi acida è presente solo in piccole quantità. La fosfatasi acida plasmatica deriva principalmente dai globuli rossi e dalle piastrine in quanto, a differenza di quanto avviene altrove, l’enzima prodotto dalla prostata non svolge la sua funzione all’interno delle cellule, ma viene secreto ed eliminato nel liquido prostatico. In condizioni normali, perciò, solo circa un terzo dell’attività presente nel siero è dovuta alla fosfatasi acida di origine prostatica e la concentrazione dell’enzima è solo di poco superiore nel maschio adulto rispetto alla donna ed al bambino.
Le fosfatasi acide di diversa origine si possono distinguere tra loro per la diversa sensibilità a vari inibitori. La formaldeide, ad esempio, inibisce la fosfatasi acida eritrocitaria, ma non quella di origine prostatica, epatica e splenica. Il tartrato inibisce quasi completamente la fosfatasi acida prostatica, in grado minore la fosfatasi acida epatica e splenica, mentre non inibisce le fosfatasi acide provenienti da altri tessuti.
La fosfatasi acida plasmatica è quasi costantemente aumentata (fino ad oltre 100 volte i valori normali) nei carcinomi prostatici metastatizzati, mentre è generalmente nei limiti della norma nei carcinomi localizzati alla prostata in quanto le cellule neoplastiche continuerebbero a versare l’enzima nel secreto prostatico. Nel caso di metastasi ossee di carcinomi prostatici l’aumento della fosfatasi acida si accompagna ad un aumento della fosfatasi alcalina, se le lesioni ossee determinano una reazione di tipo osteoblastico.
Alcuni carcinomi metastatizzati della prostata, costituiti da cellule indifferenziate, non si accompagnano ad un innalzamento della fosfatasi acida nel siero, perché le cellule neoplastiche non producono tale enzima. In questo caso la somministrazione di testosterone (25 mg di propionato di testosterone al giorno per cinque giorni; test di Sullivan) stimola la produzione di fosfatasi acida da parte delle cellule neoplastiche e ne determina l’innalzamento nel siero.
Un aumento della fosfatasi acida nel siero si osserva anche
nelle sindromi emolitiche, nei casi di intensa distruzione delle
piastrine (porpora trombocitopenica acuta
![]() ) e in varie affezioni
interessanti lo scheletro (morbo di Paget
) e in varie affezioni
interessanti lo scheletro (morbo di Paget
![]() ,
mieloma, metastasi ossee), dove si accompagna all’aumento
della fosfatasi alcalina. Nel morbo di Gaucher
,
mieloma, metastasi ossee), dove si accompagna all’aumento
della fosfatasi alcalina. Nel morbo di Gaucher
![]() aumenta la fosfatasi acida nel siero per una
sovraproduzione dell’enzima da parte delle cellule
caratteristiche di questa affezione.
aumenta la fosfatasi acida nel siero per una
sovraproduzione dell’enzima da parte delle cellule
caratteristiche di questa affezione.
9.2. ISOFORME
Le isoforme (note anche come sottoforme o sottotipi) sono il risultato di una modificazione post-trasduzionale della proteina enzimatica. Le isoforme più studiate dal punto di vista clinico sono quelle che riguardano la fosfatasi alcalina (vedi Par. 9.1.4) e la creatina chinasi.
9.2.1. Isoforme della creatina chinasi
Queste isoforme sono delle varianti degli isoenzimi MM e MB con differenti punti isoelettrici (vedi Par. 9.1.2). Esse si originano per idrolisi della lisina carbossi-terminale dalle subunità M ad opera di una carbossipeptidasi plasmatica quando la creatina chinasi viene rilasciata dalla cellula. Le isoforme MM3 e MB2 sono i prodotti genici immodificati presenti nei tessuti. Le isoforme MM2 e MB1 presentano una sola subunità M modificata, mentre la MM1 ha entrambe le subunità modificate. Il profilo delle isoforme nel siero di un soggetto normale è costituito prevalentemente dalla isoforma MM1 e da piccole quantità di MB1 e MB2, presenti in circa uguale concentrazione.
A seguito di un infarto cardiaco, si ha un rilascio dell’enzima
immodificato dal tessuto, con un rapido aumento del MM3
e del MB2 e con un cambiamento del rapporto fra le
isoforme presenti nel siero. Questo cambiamento è osservabile
precocemente, prima che il livello dell’isoenzima MB superi
i limiti normali. L’isoforma MB2, sebbene sia
presente in basse concentrazioni, ha un alto valore diagnostico
in quanto è specifica del tessuto cardiaco ed aumenta dopo 1-4
ore dall’infarto
![]() . L’analisi delle isoforme della
creatina chinasi fornisce perciò un parametro biochimico precoce
per identificare i pazienti con infarto cardiaco da sottoporre a
trattamento trombolitico. Inoltre l’analisi delle isoforme
è utile per verificare l’efficacia stessa del trattamento
trombolitico, poiché, a seguito della riperfusione del tessuto,
entro 15-30 minuti si può osservare una ulteriore immissione in
circolo delle isoforme accumulatesi nel frattempo nel miocardio
lesionato.
. L’analisi delle isoforme della
creatina chinasi fornisce perciò un parametro biochimico precoce
per identificare i pazienti con infarto cardiaco da sottoporre a
trattamento trombolitico. Inoltre l’analisi delle isoforme
è utile per verificare l’efficacia stessa del trattamento
trombolitico, poiché, a seguito della riperfusione del tessuto,
entro 15-30 minuti si può osservare una ulteriore immissione in
circolo delle isoforme accumulatesi nel frattempo nel miocardio
lesionato.
9.3. MACROENZIMI
Gli enzimi possono a volte legarsi ad altre componenti plasmatiche o formare omopolimeri ad alto peso molecolare. Questi complessi macromolecolari prendono il nome di macroenzimi. L’identificazione dei macroenzimi nel siero ha interesse clinico in quanto possono essere degli indici di malattia (in particolare di disordini autoimmuni) e indurre errori nell’interpretazione dei dati analitici. La macroamilasi fu il primo macroenzima ad essere identificato nel siero. Successivamente si scoprì che gran parte degli enzimi può essere presente in questa forma e che tale evenienza deve essere presa in considerazione ogni volta che vi sia un persistente ed inspiegabile aumento di una attività enzimatica nel siero. Dal punto di vista biochimico-clinico si distinguono i macroenzimi legati ad immunoglobuline e quelli aventi una diversa costituzione.
9.3.1. Macroenzimi legati ad immunoglobuline
I macroenzimi legati alle immunoglobuline sono formati generalmente da immunocomplessi contenenti IgG, mentre solo raramente sono stati descritti macroenzimi in cui sono presenti le IgM. L’amilasi e la lattico deidrogenasi fanno eccezione a questa regola in quanto si legano di preferenza alle IgA. Le macrolattico deidrogenasi sono spesso caratterizzate dalla presenza di immunoglobuline con sole catene leggere kappa. Sono stati descritti tuttavia numerosi casi di pazienti con macroenzimi contenenti entrambi i tipi di catene leggere o più tipi di catene pesanti (vedi Par. 8.6).
La stechiometria dell’immunocomplesso è di due molecole di enzima per molecola di anticorpo. Il legame coinvolge il frammento Fab in quanto l’immunoglobulina mantiene la capacità di legarsi all’enzima anche dopo digestione con papaina. La costante di dissociazione è simile a quella di altri complessi antigene-anticorpo ad alta affinità (10-9 - 10-11 M). Generalmente l’anticorpo è in eccesso rispetto all’enzima, ma questo non è sempre vero. Ad esempio, la macroamilasemia è stata distinta in tre tipi in base all’affinità e alla concentrazione relativa dell’anticorpo rispetto all’enzima: nei pazienti con macroamilasemia tipo 1 quasi tutto l’enzima è legato all’anticorpo, mentre i pazienti con macroamilasemia tipo 2 o 3 hanno quantità rilevanti di enzima libero.
La specificità del legame varia a seconda dell’enzima. Gli immunocomplessi con l’amilasi contengono spesso entrambi gli isoenzimi (salivare e pancreatico). Gli anticorpi verso la fosfatasi alcalina sono generalmente specifici per un singolo gruppo antigenico (il gruppo degli enzimi della placenta ed intestino o il gruppo degli enzimi del fegato ed osso), mentre non distinguono i membri all’interno di ciascun gruppo. Per quanto riguarda la lattico deidrogenasi, sono stati descritti tre tipi di anticorpi: (1) anticorpi che reagiscono sia con le subunità H che con le subunità M, (2) anticorpi specifici per la sola subunità M o, più raramente, per la sola subunità H, (3) anticorpi che si legano solo ad isoenzimi contenenti tutte e due le subunità in quanto il loro epitopo è formato da sequenze peptidiche di entrambe le catene.
Si ritiene che l’enzima, alterato dal punto di vista
biochimico, acquisti proprietà antigeniche in quanto
accidentalmente va incontro a reazioni crociate con anticorpi
contro proteine estranee all’organismo. A riprova di ciò,
è stato visto che gli anticorpi presenti nelle macroamilasi
hanno maggiore affinità per l’enzima di origine animale
presente nella carne e nei latticini e che si suppone perciò che
abbia stimolato la produzione di IgA specifiche venendo a
contatto con l’organismo a livello del tratto
gastrointestinale. Un’altra possibilità è che l’enzima
sia rilasciato da siti ove era sequestrato: ciò potrebbe
spiegare la presenza di anticorpi anti-creatina chinasi e lattico
deidrogenasi in pazienti con infarti cardiaci o di anticorpi anti-subunità
B della creatina chinasi in bambini con danni al sistema nervoso
centrale. La presenza di macroenzimi nel siero può essere
associata ad altri disordini del sistema immunitario come, ad
esempio, l’artrite reumatoide
![]() , il lupus eritematoso
, il lupus eritematoso
![]() , la
spondilite anchilosante
, la
spondilite anchilosante
![]() , l’AIDS e la crioglobulinemia (vedi
Par. 8.6.2b).
, l’AIDS e la crioglobulinemia (vedi
Par. 8.6.2b).
9.3.2. Macroenzimi di diversa costituzione
Gli enzimi del plasma possono formare complessi macromolecolari anche con sostanze diverse dalle immunoglobuline. Un esempio è dato dagli enzimi proteolitici che possono legarsi all’α2-macroglobulina (vedi Par. 8.3.3). Altri enzimi (fosfatasi alcalina, g-glutamiltransferasi, leucina aminopeptidasi, 5’-nucleotidasi) si legano a frazioni lipidiche plasmatiche quando, a seguito di una ostruzione intraepatica del flusso biliare, si ha una solubilizzazione degli enzimi di membrana ad opera della bile o una immissione in circolo di frammenti di membrane plasmatiche derivanti da cellule del sistema epatocellulare. Un’altra possibilità è che si formi un legame fra enzimi plasmatici e farmaci (ad esempio, l’amilasi può legarsi ai derivati dell’amido presenti in preparazioni iniettabili di succedanei del plasma).
E’ infine possibile che un enzima plasmatico formi degli omopolimeri. E’ questo il caso della macrocreatina chinasi tipo 2 dovuta alla presenza di creatina chinasi mitocondriale capace di dar luogo a polimeri ad alto peso molecolare, ma strutturalmente diversa dalle subunità M e B (riscontrabili invece negli immunocomplessi caratterizzanti la macrocreatina chinasi tipo 1).
9.3.3. Significato clinico
Quando un enzima è presente nel plasma sotto forma di un complesso macromolecolare, esso può raggiungere concentrazioni superiori a quelle riscontrabili di norma (nel 12% delle volte nel caso della macroamilasi e nel 0,5% delle volte nel caso della macrocreatina chinasi) in quanto può diminuire la sua clearance renale o reticoloendoteliale. L’aumento dell’attività amilasica nel siero può portare a diagnosticare erroneamente una pancreatite, mentre la presenza di macrocreatina chinasi tipo 1 o 2 può rendere difficoltosa la determinazione dell’isoenzima MB utile per la diagnosi di infarto cardiaco.
La macrocreatina chinasi tipo 2 può essere usata come marker di gravi malattie epatiche o di adenocarcinomi del tratto gastrointestinale (in quest’ultimo caso con una sensibilità del 56%). I macroenzimi del sistema epatobiliare possono essere usati per diagnosticare la presenza di metastasi epatiche o per distinguere fra ostruzioni intraepatiche ed extraepatiche. La determinazione di alcuni macroenzimi della γ-glutamiltransferasi a peso molecolare intermedio è particolarmente utile in quest’ultimo caso in quanto permette di studiare le ostruzioni biliari con una sensibilità dell’88% e una specificità del 96%.
9.4. VALUTAZIONE DEL QUADRO ENZIMATICO
La determinazione dell’attività catalitica di sei enzimi (aspartato aminotrasferasi [SGOT, AST], alanina aminotransferasi [SGPT, ALT], lattico deidrogenasi [LDH], creatina chinasi [CPK, CK], fosfatasi alcalina [ALP], γ-glutamiltranspeptidasi [γ-GT]) è entrata nella routine clinica in quanto consente di valutare non solo la funzionalità del fegato, delle vie biliari, della muscolatura cardiaca e di quella scheletrica, ma anche di evidenziare aumenti di sintesi enzimatica nelle neoplasie (lattico deidrogenasi, fosfatasi alcalina) e nelle malattie ossee (fosfatasi alcalina) o ematologiche (lattico deidrogenasi).
Nel corso di
epatopatie acute il marcato aumento della lattico deidrogenasi e delle due
transaminasi (fino ad oltre 10 volte il limite superiore di riferimento) è in
relazione con la gravità del processo morboso. Rispetto alla AST, la ALT è un
indicatore più specifico di danno epatico, in quanto quest’ultimo enzima si
trova principalmente nel fegato e di norma raggiunge livelli più alti nel
plasma. Nei processi subacuti o cronici, l’aumento è meno marcato e il rapporto
fra le due transaminasi si mantiene vicino all’unità. Nella epatopatia alcolica è indicativo
il contemporaneo aumento della γ-glutamiltranspeptidasi
![]() ,
spesso associato
ad una inversione del rapporto AST/ALT, che è conseguente ad una riduzione del
contenuto epatico di ALT, secondario ad un deficit relativo di vitamina B6.
Valori abnormi di fosfatasi alcalina e di γ-glutamiltranspeptidasi sono
osservabili nella colestasi intraepatica e nella cirrosi epatica, per
scompaginamento della normale struttura del parenchima e dei dotti biliari.
Aumenti più marcati di questi enzimi, associati a lievi o moderati aumenti delle
transaminasi, sono caratteristici sia delle ostruzioni biliari a sede
extraepatica che di processi neoplastici primitivi o secondari che interessano
il fegato (in questo ultimo caso vi è anche un aumento della lattico
deidrogenasi). Infine la γ-glutamiltranspeptidasi risulta utile nel discriminare
un aumento della fosfatasi alcalina dovuto ad una epatopatia da quello dovuto a
un coinvolgimento del tessuto osseo (ad esempio, nelle complicanze epatiche e/o
ossee durante un trattamento emodialitico cronico).
,
spesso associato
ad una inversione del rapporto AST/ALT, che è conseguente ad una riduzione del
contenuto epatico di ALT, secondario ad un deficit relativo di vitamina B6.
Valori abnormi di fosfatasi alcalina e di γ-glutamiltranspeptidasi sono
osservabili nella colestasi intraepatica e nella cirrosi epatica, per
scompaginamento della normale struttura del parenchima e dei dotti biliari.
Aumenti più marcati di questi enzimi, associati a lievi o moderati aumenti delle
transaminasi, sono caratteristici sia delle ostruzioni biliari a sede
extraepatica che di processi neoplastici primitivi o secondari che interessano
il fegato (in questo ultimo caso vi è anche un aumento della lattico
deidrogenasi). Infine la γ-glutamiltranspeptidasi risulta utile nel discriminare
un aumento della fosfatasi alcalina dovuto ad una epatopatia da quello dovuto a
un coinvolgimento del tessuto osseo (ad esempio, nelle complicanze epatiche e/o
ossee durante un trattamento emodialitico cronico).
9.4.1. Metodi di determinazione
Le proteine enzimatiche possono conservare più o meno intatta la loro attività catalitica sia all’interno delle cellule d’origine che nel plasma in cui vengono versate. E’ possibile e, a volte, utile dosare l’effettiva concentrazione dell’enzima mediante tecniche immunochimiche. In molti casi, tuttavia, è sufficiente determinare la velocità della catalisi per quantizzare il livello dell’enzima nei liquidi biologici, quando non sono presenti degli effettori capaci di modificarne l’attività.
La velocità enzimatica può essere determinata misurando la variazione della concentrazione del substrato o del prodotto di reazione mediante un metodo a due punti (al tempo zero e dopo un intervallo prefissato) utilizzando le comuni reazioni della chimica clinica. In alternativa è possibile seguire la reazione in continuo misurando la variazioni in assorbanza di un substrato o di un prodotto. Ad esempio, nel caso della lattico deidrogenasi, l’attività dell’enzima può essere determinata in base alla variazione dell’assorbanza dell’NADH a 340 nm.
![]()
Altri enzimi, come ad esempio l’aspartato aminotransferasi, richiedono una reazione accoppiata per poter essere seguiti in continuo.

Altri enzimi ancora, come ad esempio la creatina chinasi, richiedono la presenza di una ulteriore reazione ausiliaria.

La misura della velocità di reazione può essere effettuata solo quando la cinetica assume un andamento lineare. Ciò può avvenire subito dopo l’aggiunta dei reagenti o, se vi sono degli enzimi accoppiati, dopo un intervallo di tempo (lag phase) necessario perché si accumulino i prodotti intermedi nella catena di reazioni. Numerosi fattori possono interferire sulla velocità delle reazioni enzimatiche, come ad esempio il pH del mezzo di reazione, la temperatura di incubazione, la concentrazione di cofattori e/o di inibitori.
I metodi di analisi degli isoenzimi e delle isoforme possono
essere di tipo generale, se consentono di separare e, quindi, di
misurare tutte le possibili varianti presenti nel materiale
biologico, oppure possono essere selettivi, se sono diretti alla
misura di una singola specie proteica. Al primo gruppo
appartengono i metodi elelettroforetici
![]() , cromatografici o di
focalizzazione al punto isoelettrico (Fig. 9.1).
Al secondo gruppo appartengono i metodi che utilizzano inibitori
chimici specifici, anticorpi inattivanti, o una denaturazione
termica selettiva.
, cromatografici o di
focalizzazione al punto isoelettrico (Fig. 9.1).
Al secondo gruppo appartengono i metodi che utilizzano inibitori
chimici specifici, anticorpi inattivanti, o una denaturazione
termica selettiva.
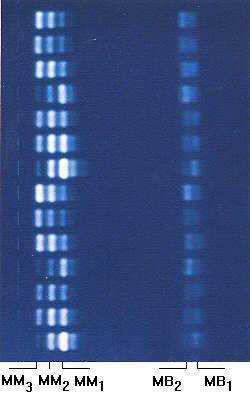
Fig. 9.1. Identificazione delle isoforme della creatina chinasi. L’esempio presentato mostra la separazione elettroforetica di 14 diversi campioni di plasma su gel di agarosio. Le isoforme sono state rese visibili aggiungendo direttamente i substrati sulla lastrina ed evidenziando l’NADPH, prodotto dalla catena di reazioni enzimatiche, in base alla sua fluorescenza. La banda MM3 è in posizione catodica ed è la più lenta, mentre la banda MB1 è in posizione anodica ed è quella con maggiore mobilità elettroforetica. Una determinazione semiquantitativa della concentrazione relativa delle diverse isoforme può essere ottenuta per mezzo di un fotometro a scansione.
Un metodo selettivo per l’individuazione dell’LDH1, che è stato a lungo usato, si basava sulla capacità della subunità H della lattico deidrogenasi di catalizzare la reazione
![]()
Tuttavia, poiché la subunità H è presente non solo nell’LDH1, ma anche in altri tre isoenzimi della lattico deidrogenasi (LDH2, LDH3, LDH4), un aumento dell’attività verso l’α-idrossibutirrato è osservabile anche nei disordini epatocellulari e nel 70% dei pazienti sottoposti ad interventi ortopedici che comportino un danno del muscolo scheletrico. Anche l’utilizzo del rapporto tra l’attività verso l’α-idrossibutirrato e quella verso il lattato non si è dimostrato dirimente ai fini diagnostici in quanto non discrimina fra un soggetto normale ed uno con infarto cardiaco complicato da shock cardiogeno o congestione epatica.
I metodi di dosaggio dei macroenzimi prevedono la separazione del complesso macromolecolare mediante elettroforesi, precipitazione in polietilenglicol o misure di stabilità termica delle proteine. La presenza di macroamilasi può essere valutata anche determinando il rapporto fra la clearance renale dell’amilasi e quella della creatinina.
9.4.2. Preparazione del campione ed intervalli di riferimento
L’attività enzimatica è generalmente determinata su siero. La presenza di emolisi nel campione inficia la misura quando l’enzima è presente in alte concentrazioni nelle emazie, come è nel caso della lattico deidrogenasi. La determinazione delle isoforme della creatina chinasi viene eseguita su plasma trattato con EDTA e 2-mercaptoetanolo allo scopo di impedire che la carbossipeptidasi reagisca con la forma tessutale dell’isoenzima e la converta nella forma sierica.
La determinazione dell’amilasi nelle urine rientra nella diagnostica routinaria delle pancreopatie (Par. 9.1.3). La determinazione del livello di lisozima, α-glicosidasi, N-acetil-β-glicosaminidasi e alanina aminopeptidasi nelle urine ha particolare significato diagnostico nelle nefropatie (Par. 11.2c; Par. 11.2d).
Allo stato attuale, non sono disponibili preparazioni enzimatiche dotate di attività catalitica stabile e definita. L’uso di metodi profondamente diversi per principi analitici ed unità di misura e la mancanza di soluzioni standard sono la causa principale della grande variabilità esistente da laboratorio a laboratorio nel campo dell’enzimologia clinica. Per arrivare ad una uniformità e confrontabilità dei dati è stata perciò proposta l’adozione di metodi standard che fornissero dati paragonabili e ripetibili. I metodi sono stati "ottimizzati" in modo da assicurare l’attività massima e caratteristiche accettabili di precisione. Nella pratica, tuttavia, è spesso impossibile lavorare a concentrazioni saturanti di substrato (che assicurino la velocità massima di reazione) per la presenza di inibizioni da substrato o per la scarsa solubilità di quest’ultimo. I metodi ottimizzati sono stati inoltre variamente modificati in funzione dell’attrezzatura disponibile nei singoli laboratori.
| aggiornamento: 18/07/11 |