Abschnittsübersicht
-
-
Annunci e news di carattere generale
-
-
Applicazioni Biochimiche e Biotecnologiche
Aula B Chimica Farmaceutica - CU019 Città universitaria)
--> Le lezioni inizieranno il giorno 1 Ottobre 2025 (Mercoledì 13:00-15:00)
(orario: Martedì 13:00-16:00, Mercoledì 13:00-15:00) -
MODULO GOOGLE - Iscrizione al corso
https://docs.google.com/forms/d/1pwX-11Bbd6AmqrAgP2tQdgfF-3DWtZWg6v_-93Oka9k/edit
-
Docente: dott.ssa Silvia Chichiarelli
Ricercatore SSD: BIO/10 - biochimica
Dip.to di Scienze Biochimiche "A. Rossi Fanelli" - II Piano - Stanza 202
Università "La Sapienza" - P.le A.Moro 5 - 00185 RomaStruttura di afferenza: 
Dip.to Scienze Biochimiche "A. Rossi Fanelli" Tel: +39 0649910598 Email: silvia.chichiarelli@uniroma1.it Ricevimento studenti: 1- Per appuntamento tramite e-mail
2- Al termine delle lezioni -
Anno 4° anno Tipologia A scelta dello studente Crediti/Valenza 8 CFU Anno Accademico 2023/24 Periodo didattico primo semestre
Denominazione Insegnamento APPLICAZIONI BIOCHIMICHE e BIOTECNOLOGICHE PROVA DI ESAME Esame Orale ___________________________________
Il principale obiettivo del corso di Applicazioni biochimiche e Biotecnologiche è quello di permettere allo studente uno studio più approfondito delle tecniche biochimiche, di biologia molecolare e biotecnologiche, per prepararlo all’utilizzo delle stesse tecniche nello sviluppo, in modo creativo ed inventivo, di nuove strategie di indagine, di nuovi approcci diagnostici e terapeutici per condizioni patologiche.
___________________________________
PROGRAMMA
1° settimana
Principi generali delle metodologie biochimiche e di biologia molecolare.
Tecniche di base (Soluzioni tampone. Metodi di omogeneizzazione meccanici e non meccanici. Centrifugazione: ultracentrifuga preparativa ed analitica e loro applicazioni; velocità ed equilibrio di sedimentazione; centrifugazione su gradiente di densità; centrifugazione, zonale ed isopicnica. Dialisi e ultrafiltrazione. Cromatografia: scambio ionico (autoanalizzatore di amminoacidi); ad esclusione molecolare; di affinità. Spettroscopia: Spettrofotometria visibile ed UV: aspetti teorici, strumentazione ed applicazioni nella ricerca biochimica. Spettrofluorimetria. Cenni Radioisotopia)2° settimana
Esempi di progettazione di un esperimento, consultazione della letteratura scientifica.
Modelli di sperimentazione biologica.
Colture cellulari: il laboratorio di colture di cellulari; metodi di coltura di cellule; medium di coltura; separazione ed analisi delle popolazioni di cellule; conteggio e conservazione; citometria a flusso, FACS e MACS. Applicazione di composti marcati in biologia. Tecniche di Purificazione delle proteine (es. purificazione mediante cromatografia per affinità: magnetic beads; Immobilized metal ion affinity chromatography, IMAC).3° settimana
Elettroforesi: principi e fattori che regolano la migrazione di una biomolecola in un campo elettrico. Elettroforesi nativa; SDS-PAGE; Elettroforesi degli acidi nucleici. Isoelectrofocusing. 2D_SDS-PAGE. Elettroforesi capillare. Metodi di rivelazione colorimetrici ed immunologici di proteine analizzate mediante elettroforesi (Western Blotting).
4° settimana
L’immunochimica: principi della reazione antigene-anticorpo. Tecniche immunoenzimatiche (ELISA; EMIT; CEDIA): ELISA diretto, indiretto, sandwich. Utilizzo dell’Elisa per dosaggi quantitativi di Ag ed Ab in campioni biologici. Tecniche per lo studio del binding ligando-recettore.
5° settimana.
Tecniche di manipolazione del DNA e RNA: Estrazione degli acidi nucleici; Separazione elettroforetica del DNA ed RNA; Southern e Northen blotting (Tecniche di blotting);
6° settimana
Marcatura delle sonde di ibridizzazione; Electrophoretic mobility shift assay (EMSA); L’immunoprecipitazione (Co-IP; ChIP; X-ChIP); Microarrays.
7° settimana
Sintesi chimica e sequenziamento del DNA; Endonucleasi di restrizione; Vettori di clonaggio. Vettori di espressione in procarioti ed eucarioti. Produzione di proteine in procarioti ed eucarioti (esempi di proteine ricombinanti utilizzate in terapia).
8° settimana
PCR end-point; RT-PCR; RealTime PCR, Single-cell qRT-PCR; Mutagenesi in vivo ed in vitro; PCR nella mutagenesi sito specifica, in diagnostica e nella medicina personalizzata.
9° settimana
Produzione di Organismi geneticamente modificati (OGM; modelli murini per la clinica); MicroRNA; RNA interference e SiRNA (es. uso in terapia). Genome Editing (es. Crispr/CAS system) e applicazioni terapeutiche. Cenni su Cellule staminali.
10° settimana
Metodologie per la produzione di vaccini ricombinanti e Anticorpi umanizzati. Utilizzo di virus o anticorpi ricombinanti in terapia (es: anti-tumorali).
11° settimana
Principi di purificazione enzimatica e principali tecniche di dosaggio enzimatico. (Cinetica, regolazione e Inibizione enzimatica). Immobilizzazione enzimatica, Cinetica enzimi immobilizzati, Biosensori (es. in diagnostica).
12° settimana.
Enzimologia clinica: enzimi in diagnostica (enzimi strumenti di diagnosi); enzimopatie; enzimopatie genetiche e terapie sostitutive.
Testi adottati e bibliografia di riferimento
Bonaccorsi MC, Contestabile R, Di Salvo M "Metodologie biochimiche - Espressione, purificazione e caratterizzazione delle proteine" Seconda edizione - Zanichelli (2019) - ISBN: 9788808520586
Mauro Maccarrone "Metodologie biochimiche e biomolecolari - Strumenti e tecniche per il laboratorio del nuovo millennio" - Zanichelli (2019) - ISBN: 9788808520555
Nanette Pazdernik & David Clark, “Biotechnology” (2nd Edition) – Ed. Elsevier Science & Technology, Academic Cell; ISBN: 978-0-12-385015-7 (2015)
Benjamin E. Blass “Basic Principles of Drug Discovery and Development” – Ed. Academic Press; ISBN-10: 012411508X or ISBN-13: 978-0124115088 (2015)
Terry A. Brown "Biotecnologie molecolari" - Principi e tecniche Seconda edizione italiana condotta sulla settima edizione inglese Ed. Zanichelli. (2017) - [“Gene Cloning and DNA analysis: An introduction”, John Wiley & Sons - ISBN: 978-1-119-07256-0 (2016)]
Denise R Ferrier “Le basi della biochimica” Seconda edizione italiana condotta sulla sesta edizione americana (2014)
Dean R. Appling - Spencer J. Anthony-Cahill - Christopher K. Mathews “Biochimica - Molecole e metabolismo • Con Mastering Chemistry™” Ed. Pearson (2017)
Terry A. Brown “Conoscere la Biochimica “Trad. di N. Taddei e G. Maga - Ed. Zanichelli. (2018)
Materiale didattico fornito dal Docente. (Lectures notes/slides)___________________________________
Objectives
The aim of the Biochemical and Biotechnological Applications course is to allow the student an in-depth knowledge of biochemical and biotechnological techniques from both a theoretical and practical perspective. The final aim is to prepare him/her to make use of these techniques to develop, in a creative and inventive way, new investigation strategies as well as new diagnostic and therapeutic approaches to pathologies.
Course Description
1st week
Principles of Biochemistry and Molecular Biology.
Basic techniques (Mechanical and non-mechanical homogenization methods). Centrifugation: preparative and analytical ultracentrifuge; sedimentation speed and balance; centrifugation in density gradient; zonal and isopicnic centrifugation; dialysis and ultrafiltration. Affinity, Gel filtration, Ion exchange and Reverse phase chromatography. Spectroscopy: visible and UV spectrophotometry: theoretical aspects, instrumentation and analysis in biochemical research. Spectrofluorimetry. Outline of the radioisotopic techniques).2nd week
Examples of Experimental design, Evaluation of Scientific Literature.
Models in biological research.
Cell cultures methods; culture media; cell sorting and analysis; cell counts and cryogenic storage; flow cytometry, FACS and MACS. Application of labelled compounds in biology. Protein purification techniques: magnetic beads, affinity chromatography for immobilized metal ions, IMAC.3rd week
Principles of electrophoresis: migration of a biomolecule in an electric field. Native electrophoresis; SDS-PAGE; Electrophoresis of nucleic acids. Isoelectric focusing. 2D_SDS-PAGE. Capillary electrophoresis. Colorimetric and immunological detection methods (Western Blotting).
4th week
Immunochemistry: principles of the antigen-antibody interaction. Immunoenzymatic techniques (ELISA, EMIT, CEDIA): direct, indirect, sandwich ELISA. ELISA to quantify Ag and Ab in biological samples. Techniques to study the ligand-receptor binding.
5th week.
DNA and RNA manipulation techniques: nucleic acids extraction; Electrophoretic separation of DNA and RNA; Southern and Northen blotting (blotting techniques).
6th week
Hybridization Probe Design, Production and Applications; Electrophoretic mobility shift Assay (EMSA); Immunoprecipitation (Co-IP; ChIP; X-ChIP); Microarrays.
7th week
DNA synthesis and sequencing; Restriction enzymes; Cloning vectors; prokaryotic and eukaryotic expression vectors; Protein production in prokaryotes and eukaryotes (examples of recombinant proteins in therapy).
8th week
PCR principles; PCR end-point; RT-PCR; RealTime PCR; in vivo and in vitro mutagenesis; PCR in site-directed mutagenesis, in diagnostics and in personalized medicine.
9th week
Process of genetic modification: genetically modified organisms (GMOs, mouse models in clinic). MicroRNA; Interference with RNA and SiRNA (therapeutic use). Genome modification (Crispr / CAS system) and therapeutic application of the mentioned techniques. Outlines on Stem Cells.
10th week
Production of recombinant vaccines and humanised antibodies. Use of recombinant viruses or antibodies in therapy (e.g. anti-tumour).
11th week
Enzymatic purification: principles and quantification (kinetics, regulation and inhibition). Enzyme immobilization, kinetics of immobilized enzymes, Biosensors (diagnostic use).
12th week.
Clinical enzymology: enzymes in diagnostics (enzymes as diagnostic tools); enzymopathies; genetic enzymopathies and outline of Enzyme replacement therapy and Enzyme therapies (e.g. in cancer).
Suggested textbooks
Bonaccorsi MC, Contestabile R, Di Salvo M "Metodologie biochimiche - Espressione, purificazione e caratterizzazione delle proteine" Seconda edizione - Zanichelli (2019) - ISBN: 9788808520586
Mauro Maccarrone "Metodologie biochimiche e biomolecolari - Strumenti e tecniche per il laboratorio del nuovo millennio" - Zanichelli (2019) - ISBN: 9788808520555
Nanette Pazdernik & David Clark, “Biotechnology” (2nd Edition) – Ed. Elsevier Science & Technology, Academic Cell; ISBN: 978-0-12-385015-7 (2015)
Benjamin E. Blass “Basic Principles of Drug Discovery and Development” – Ed. Academic Press; ISBN-10: 012411508X or ISBN-13: 978-0124115088 (2015)
Terry A. Brown "Biotecnologie molecolari" - Principi e tecniche Seconda edizione italiana condotta sulla settima edizione inglese Ed. Zanichelli. (2017) - [“Gene Cloning and DNA analysis: An introduction”, John Wiley & Sons - ISBN: 978-1-119-07256-0 (2016)]
Denise R Ferrier “Le basi della biochimica” Seconda edizione italiana condotta sulla sesta edizione americana (2014)
Dean R. Appling - Spencer J. Anthony-Cahill - Christopher K. Mathews “Biochimica - Molecole e metabolismo • Con Mastering Chemistry™” Ed. Pearson (2017)
Terry A. Brown “Conoscere la Biochimica “Trad. di N. Taddei e G. Maga - Ed. Zanichelli. (2018)
Materiale didattico fornito dal Docente. (Lectures notes/slides) -
Giorno Orario AULA Martedì 13:00 - 17:00 Aula B, Dip.to Chimica Farmaceutica - CU019
Mercoledì 13:00 - 15:00 Aula B, Dip.to Chimica Farmaceutica - CU019
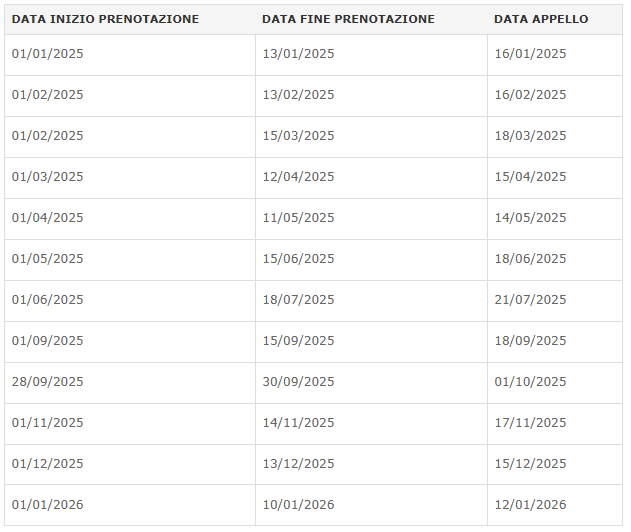
Corso del IV Anno (I semestre A.A. 2025/26)
Lezioni: dal 01/10/2025 al 15/01/2026
Silvia Chichiarelli
(Docente del corso)___________________________________________________________________________
-
Gli studenti sono invitati a registrarsi al Corso, in modo tale da essere raggiunti da eventuali comunicazioni del Docente.